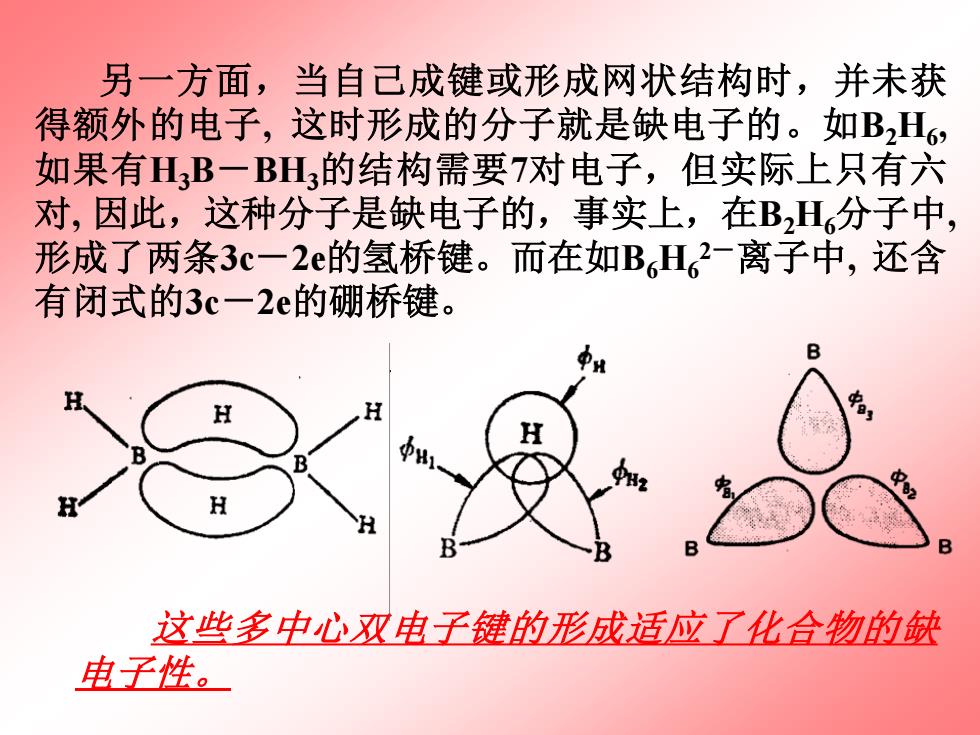
另一方面,当自己成键或形成网状结构时,并未获 得额外的电子,这时形成的分子就是缺电子的。如B2H6, 如果有H,B一BH,的结构需要7对电子,但实际上只有六 对,因此,这种分子是缺电子的,事实上,在B2H分子中, 形成了两条3c一2e的氢桥键。而在如BH,2-离子中,还含 有闭式的3c一2e的硼桥键。 B H H H 这些多中心双电子键的形成适应了化合物的缺 电子性
这些多中心双电子键的形成适应了化合物的缺 电子性。 另一方面,当自己成键或形成网状结构时,并未获 得额外的电子, 这时形成的分子就是缺电子的。如B2H6 , 如果有H3B-BH3的结构需要7对电子,但实际上只有六 对, 因此,这种分子是缺电子的,事实上,在B2H6分子中, 形成了两条3c-2e的氢桥键。而在如B6H6 2-离子中, 还含 有闭式的3c-2e的硼桥键

六富电子分子的分子轨道 成键轨道已经填有电子的分子,若再向体系中加入电子,新 加入的电子或者填入非键轨道对成键不起加强作用(键级不变), 或者填入反键轨道使成键作用削弱(键级减小)。 在02分子中加入电子是属于多余的电子填入反键轨道的情况: 分子轨道 键级 键离解能 kJ.mol- 02:(,)2(o*)2()2(π)4(π)(πz)(x) 2 494 02:()2(s)2()2(π.4(匹)2(πz)(x) 1.5 395 022-:(,)2()2()2((元y)2(πz)2(o)° 1 126 在反键轨道中填入电子 成键作用削弱键级诚小,键能诚小
成键作用削弱,键级减小,键能减小. 六 富电子分子的分子轨道 成键轨道已经填有电子的分子,若再向体系中加入电子,新 加入的电子或者填入非键轨道对成键不起加强作用(键级不变), 或者填入反键轨道使成键作用削弱(键级减小)。 在O2分子中加入电子是属于多余的电子填入反键轨道的情况: 分 子 轨 道 键级 键离解能 kJmol-1 O2 :(s ) 2 (s * ) 2 (x ) 2 (y,z) 4 (y * ) 1 (z * ) 1 (x * ) 0 2 494 O2 - :(s ) 2 (s * ) 2 (x ) 2 (y,z) 4 (y * ) 2 (z * ) 1 (x * ) 0 1.5 395 O2 2-:(s ) 2 (s * ) 2 (x ) 2 (y,z) 4 (y * ) 2 (z * ) 2 (x * ) 0 1 126 在反键轨道中填入电子

七共价键的极性 当两个不同种原子形成共价键时,如果两个 原子的电负性不同,成键电子就会在一定程度上 偏向电负性大的原子,结果共价键就有了极性, 此时共价键的一端的原子略带正电荷,另一端的 原子略带负电荷,换句话说,共价键显示出了一 定的离子性
七 共价键的极性 当两个不同种原子形成共价键时,如果两个 原子的电负性不同,成键电子就会在一定程度上 偏向电负性大的原子,结果共价键就有了极性, 此时共价键的一端的原子略带正电荷,另一端的 原子略带负电荷,换句话说,共价键显示出了一 定的离子性

可由下两个经验公式计算共价键的离子性百分数: ■离子性百分数=16(△X)+3.5(△X)]% 其中△X为两个原子的电负性差 ■离子性百分数=[1一e-(△x4100% 以HC为例△X=3.0-2.1=0.9 ■离子性百分数=[16(0.9)+3.5(0.9)2]%=17% ■离子性百分数=[1一e-0.4]%=18%
可由下两个经验公式计算共价键的离子性百分数: ■离子性百分数=[16(△)+3.5(△) 2 ]% 其中△为两个原子的电负性差 ■离子性百分数= [1-e-(△) /4 ]100% 2 ■离子性百分数=[16(0.9)+3.5(0.9) 2 ]%=17% 以HCl为例 △=3.0-2.1=0.9 ■离子性百分数=[1-e-(0.9) /4]%=18% 2

键的极性可以用偶极矩来衡量 Aò+—B- 4=q 式中u是偶极矩值,单位是库仑·米,q为电荷,为键长。偶 极矩是一个矢量,其方向是由正到负。 显然,键的极性越大,偶极矩越大。 如果知道了偶极距和键长,则电荷可求: 仍以HC1为例,1=127pm=1.27×10-10m μ=3.44×10-20Cm由于1e=1.6×10-19C q=4=3.44X10-0Cm le -=0.17e 11.27×10-10m1.6×10-19 即,δH+=+0.17eδc-=-0.17e HCI的离子性百分数17%意味着H提供0.17个价电子给C1原子 ,,从而H带0.17个正电荷,C1带0.17个负电荷。 由偶极矩算得的电荷值与离子性百分数计算公式所得的结果完全一致
由偶极矩算得的电荷值与离子性百分数计算公式所得的结果完全一致。 键的极性可以用偶极矩来衡量 Aδ+——→ Bδ- =q·l 式中是偶极矩值,单位是库仑·米,q为电荷,l为键长。偶 极矩是一个矢量,其方向是由正到负。 显然,键的极性越大,偶极矩越大。 如果知道了偶极距和键长,则电荷可求: 仍以HCl为例,l=127 pm=1.27×10-10 m =3.44×10-20 C·m 由于1e=1.6×10-19 C 3.44×10-20 C·m 1e q=-=———————×—————=0.17e l 1.27×10-10 m 1.6×10-19 C 即,δH+=+0.17e δCl-=-0.17e HCl的离子性百分数17%意味着H提供0.17个价电子给Cl原子 ,从而H带0.17个正电荷,Cl带0.17个负电荷