
2.2几种简单分子的分子轨道能级图 一同核双原子分子 02和N2代表了第二周期同核双原子分子的两种类型。 其中02和F2属于 02分子轨道的类型, 这种类型的特点是s、 p,能量差较大,不会产 A-p· g 0,0 生s一P,相互作用,此 相互作用 相互作用 时s,的能量低于元和元v 0 25 Li2、Be2、B2、C2 N2都属于N2的类型,这 种类型的特点是原子轨 () 道的s和p,能量差较小 y s和p,轨道产生了一 02 N2 定程度的相互作用,因 而造成o,高于兀和元
其 中 O2 和 F2 属 于 O2分子轨道的类型, 这种类型的特点是s、 pz能量差较大,不会产 生s-pz相互作用,此 时z的能量低于x和y ; Li2、Be2、B2、C2、 N2都属于N2的类型, 这 种类型的特点是原子轨 道的s和pz能量差较小 ,s和pz轨道产生了一 定程度的相互作用,因 而造成z高于x和y。 2.2 几种简单分子的分子轨道能级图 O2和N2代表了第二周期同核双原子分子的两种类型。 O2 N2 一 同核双原子分子

二异核双原子分子(CO和NO) CO和NO的分子轨道能级图可作为异核双原子分子的代表。 CO的分子轨道能级图 C0的总电子数为10,N2分子的价电子总数也为10,C0与 N2为等电子体,其结构应该相似。但是,C原子和O原子的电 负性差较大(△X=3.5一2.5=1)。能量上,0的2s轨道的能量低 于C的2s轨道的能量12.92eV,而C原子的2s轨道比0原子的2p 轨道能量仅差3.54eV,前者低仅3.54eV。 2p 5.17eV 2p 2s 3.54eV 12.92eV 2s C 用原子轨道先经杂化,然后再组合成键能够满意地解释CO 与N2分子结构上的相似性
CO的分子轨道能级图 CO的总电子数为10,N2分子的价电子总数也为10,CO与 N2为等电子体,其结构应该相似。但是,C原子和O原子的电 负性差较大(△=3.5-2.5=1)。能量上,O的2s 轨道的能量低 于C的2s轨道的能量12.92 eV,而C原子的2s轨道比O原子的2p 轨道能量仅差3.54 eV,前者低仅3.54 eV。 用原子轨道先经杂化,然后再组合成键能够满意地解释CO 与N2分子结构上的相似性。 C O 12.92 eV 3.54 eV 5.17 eV 2p 2s 2s 2p 二 异核双原子分子( CO和NO) CO和NO的分子轨道能级图可作为异核双原子分子的代表
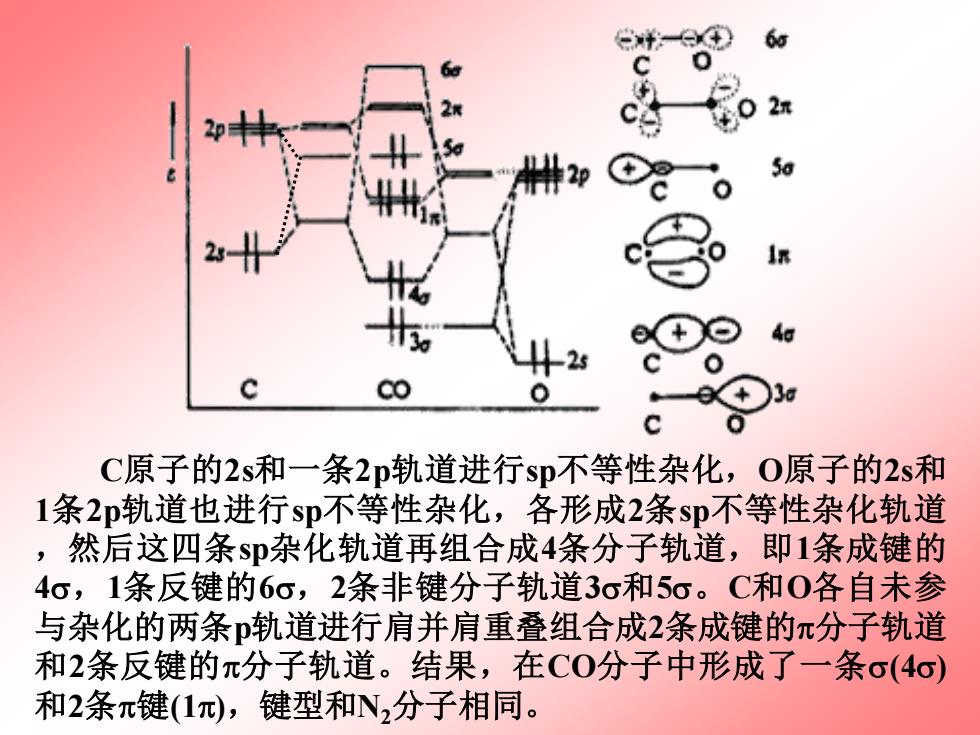
6 2 C原子的2s和一条2p轨道进行sp不等性杂化,O原子的2s和 1条2p轨道也进行sp不等性杂化,各形成2条sp不等性杂化轨道 ,然后这四条s即杂化轨道再组合成4条分子轨道,即1条成键的 4o,1条反键的6o,2条非键分子轨道3o和5o。C和0各自未参 与杂化的两条p轨道进行肩并肩重叠组合成2条成键的π分子轨道 和2条反键的π分子轨道。结果,在CO分子中形成了一条σ(4o) 和2条π键(1),键型和N2分子相同
C原子的2s和一条2p轨道进行sp不等性杂化,O原子的2s和 1条2p轨道也进行sp不等性杂化,各形成2条sp不等性杂化轨道 ,然后这四条sp杂化轨道再组合成4条分子轨道,即1条成键的 4,1条反键的6,2条非键分子轨道3和5。C和O各自未参 与杂化的两条p轨道进行肩并肩重叠组合成2条成键的分子轨道 和2条反键的分子轨道。结果,在CO分子中形成了一条(4) 和2条键(1),键型和N2分子相同
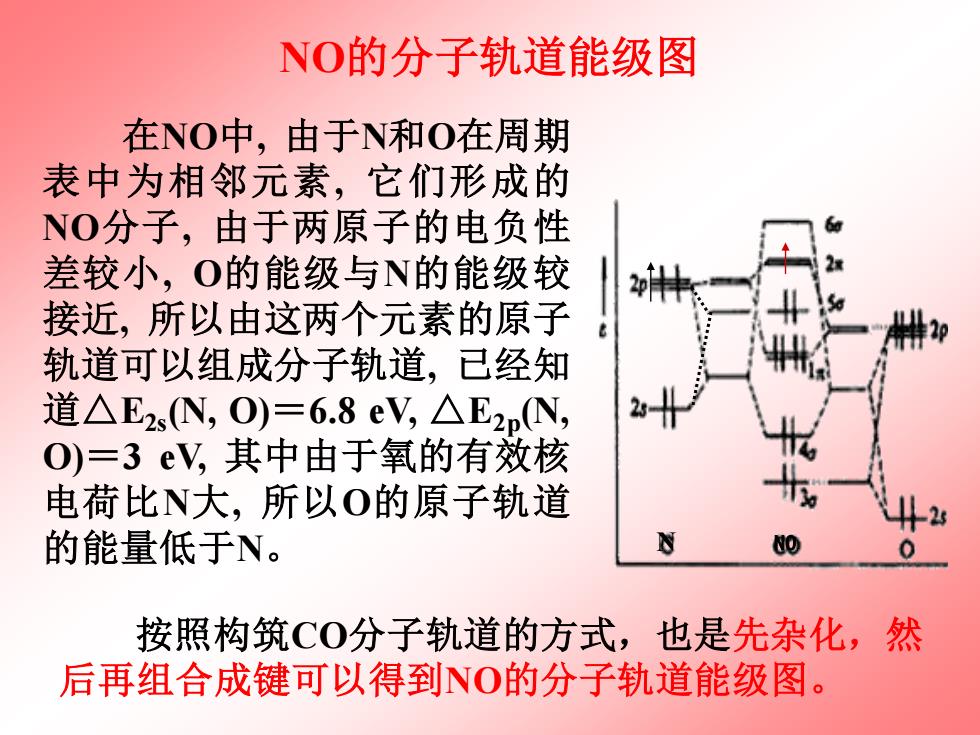
NO的分子轨道能级图 在NO中,由于N和O在周期 表中为相邻元素,它们形成的 NO分子,由于两原子的电负性 差较小,O的能级与N的能级较 接近,所以由这两个元素的原子 轨道可以组成分子轨道,已经知 道△E2sN,O)=6.8eV,△E2pN, O)=3eV,其中由于氧的有效核 电荷比N大,所以O的原子轨道 的能量低于N。 按照构筑CO分子轨道的方式,也是先杂化,然 后再组合成键可以得到NO的分子轨道能级图
在NO中, 由于N和O在周期 表中为相邻元素, 它们形成的 NO分子, 由于两原子的电负性 差较小, O的能级与N的能级较 接近, 所以由这两个元素的原子 轨道可以组成分子轨道, 已经知 道△E2s (N, O)=6.8 eV, △E2p (N, O)=3 eV, 其中由于氧的有效核 电荷比N大, 所以O的原子轨道 的能量低于N。 NO的分子轨道能级图 N NO 按照构筑CO分子轨道的方式,也是先杂化,然 后再组合成键可以得到NO的分子轨道能级图

N、O两元素的价电子总数为5 +6=11,依次填入分子轨道,显然 ,最后一个电子填在反键上,不成 2 对,因此,在NO的分子中有一条o键 ,一条2电子π键,一条3电子π键。 键级=(6-1)/2=2.5 由于有成单电子,NO分子具 有顺磁性,可以自聚合成为N2O2双 聚分子。而且也可预料,NO易失去 一个电子成为NO+,NO+离子有 二条2电子π键,一条o键,键级为3: 成键能力显然比NO高
N 、 O两元素的价电子总数为 5 + 6 =11 ,依次填入分子轨道 , 显然 , 最后一个电子填在反键上 , 不成 对 , 因此 , 在NO的分子中有一条 键 , 一条 2电子 键 , 一条 3电子 键 。 键级=(6 -1)/2 =2.5 由于有成单电子 ,NO分子具 有顺磁性 , 可以自聚合成为 N 2 O 2 双 聚分子 。而且也可预料 , NO易失去 一个电子成为NO + ,NO +离子有 二条 2电子 键 ,一条 键 ,键级为 3 , 成键能力显然比NO 高 。 N NO