第一节强电解质溶液理论一些强电解质的离子平均活度因子(25℃)0.10.51.0b/ (mol-kgil)0.0010.0050.010.05HCI0.9660.7960.7530.9280.9040.8030.809KOH0.960.930.800.730.900.820.76KCI0.9650.9270.9010.8150.7690.6510.6060.8300.6370.5440.340H2SO40.2650.1540.1300.770.710.540.480.380.350.88Ca(NO3)20.740.530.410.210.16CuSO40.0680.047
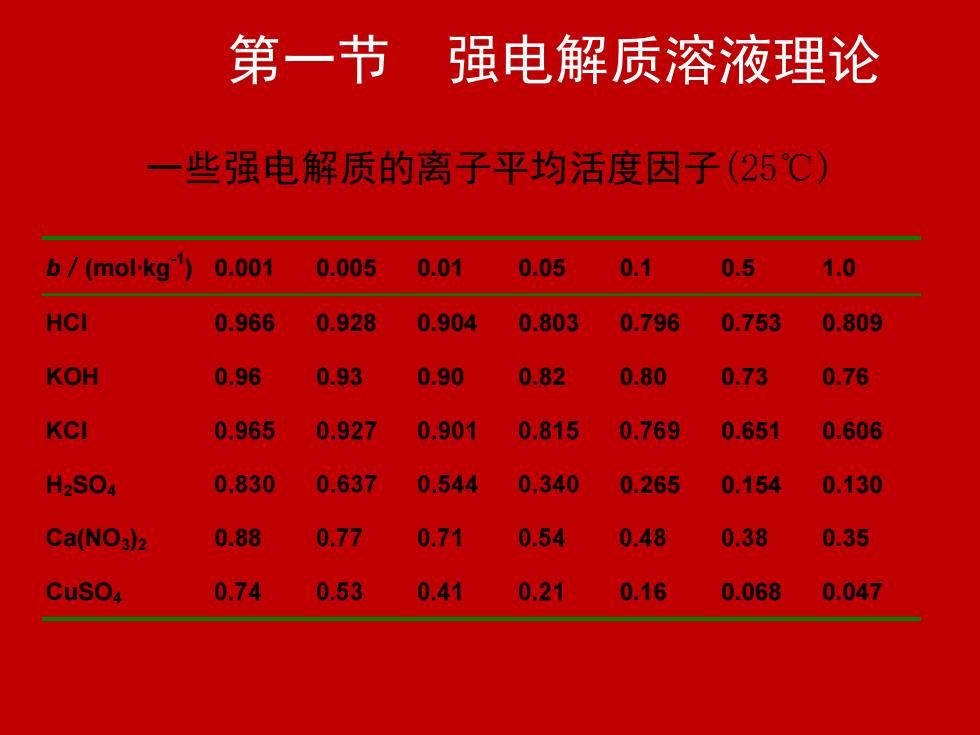
第一节 强电解质溶液理论 一些强电解质的离子平均活度因子(25℃) b/(mol·kg-1 ) 0.001 0.005 0.01 0.05 0.1 0.5 1.0 HCl 0.966 0.928 0.904 0.803 0.796 0.753 0.809 KOH 0.96 0.93 0.90 0.82 0.80 0.73 0.76 KCl 0.651 0.606 H2SO4 0.265 0.154 0.130 Ca(NO3)2 0.88 0.35 CuSO4 0.16 0.068 0.047

第一节强电解质溶液理论离子强度:离子的活度因子是溶液中离子间作4用力的反映,与离子浓度和所带电荷有关defb,zb和分别为溶液中第种离子的质量摩尔浓度和该离子的电荷数,近似计算时,也可以用c代替b。I的单位为molkg-l
第一节 强电解质溶液理论 4. 离子强度:离子的活度因子是溶液中离子间作 用力的反映,与离子浓度和所带电荷有关 bi和zi分别为溶液中第i种离子的质量摩尔浓度 和该离子的电荷数,近似计算时,也可以用ci 代替bi。I的单位为mol·kg-1 。 = i i i I b z 2 def 2 1

第一节强电解质溶液理论例计算:(1)0.010mol·kg!NaCl溶液的离子强度、活度因子、活度和25℃时的渗透压解 (1) = 1/2[ b(Nat)-2(Nat)+b(CI)-2(CI))=[0.010 molkg/×(+1)2+0.010mol-kg(-1))=0.010 mol-kgIg ± =-A/=→-=/V/ =-0.509kgl/2.mol1/2 ×(+1)x(-1)× /0.010mol -kg=-0.051X±=0.89a± = ±·b/b°=0.89×0.010mol-kg"/(lmol -kg-")=0.0089c(NaCl)=0.0089molL-1根据Ⅱ-icRRT,2=2X0.0089 mol·L-lX8.314J·mol-LK-lX298.15 KX 1KPa-L/1J = 44kPa
第一节 强电解质溶液理论 例 计算:(1) 0.010 mol·kg-1 NaCl溶液的离子强度、活度因子、活 度和25℃时的渗透压。 解 (1) I = 1/2[ b(Na+ )z 2 (Na+ )+b(Cl- )z 2 (Cl- )] = [0.010 mol·kg-1×(+1)2+0.010 mol·kg-1 (-1)2 ] = 0.010 mol·kg-1 c(NaCl) ≈ 0.0089 mol·L-1 根据П=icBRT , i=2 П=2×0.0089 mol·L-1×8.314 J·mol-1·K-1×298.15 K ×1 KPa·L/1J = 44 kPa 0.051 0.89 lg A 0.509kg mol ( 1) ( 1) 0.010mol kg 1/2 1/ 2 1 = − = = − = − + − − + − z z I 0.89 0.010mol kg /(1mol kg ) 0.0089 θ -1 1 = B = = − a b /b

第一节强电解质溶液理论(2)0.020molkglKBr+0.030mol-kg/ZnSO.溶液的离子强度解: I=[b(Kt)-2(K) + b(Br)--(Br) +b(Zn2+)=2(Zn2+) +b(SO42-)=-(SO42-))=[(0.020mol-kg')(+1) + (0.020mol-kg)(-1)2 +(0.030mol-kgl)(+2)2 + (0.030 molkg-l)(-2)2)=0.14mol-kgl对于1-1价型及2-2价型的强电解质,bZ。故上述可简化计算:1=I(KBr)+I(ZnSO4)= 0.020 mol-kglX12+0.030 mol-kglX22=0.14mol:kg
第一节 强电解质溶液理论 (2) 0.020 mol·kg-1KBr+0.030 mol·kg-1ZnSO4溶液的离子强度 。 解:I = [b(K+ )z 2 (K+ ) + b(Br- )z 2 (Br- ) + b(Zn2+)z 2 (Zn2+) + b(SO4 2- )z 2 (SO4 2- )] = [(0.020mol·kg-1 )(+1)2 + (0.020mol·kg-1 )(-1)2 + (0.030mol·kg-1 )(+2)2 + (0.030 mol·kg-1 )(-2)2 ] = 0.14 mol·kg-1 对于1-1价型及2-2价型的强电解质,I=bZ2。故上述可简化 计算: I = I(KBr) + I(ZnSO4 ) = 0.020 mol·kg-1×1 2+0.030 mol·kg-1×2 2=0.14 mol·kg- 1

第一节强电解质溶液理论Debye一Huckel理论:4Ig X,=-A-2 VI平均活度因子Ig + = -A2++z.NI对于较高离子强度的溶液gn=二AV-AVI或IgX+1-VI1-VI
第一节 强电解质溶液理论 4. Debye—Hückel理论 : • 平均活度因子 • 对于较高离子强度的溶液 z I 2 i A i lg = − z z I + − lg = −A I z I − − = 1 A lg 2 i i I z z I − − = + − 1 A 或 lg