
16属-重气体卷 干经验规律,例如Boyle-Marriote(波义耳-马利奥特)定律,Charles-Gay-Lus sc(查理-盖·吕萨克)定律,以及由此而导出的理想气体状态方程式(V= nRT),此外还有Dalton(道尔顿)分压定律,Avogadro(阿伏加德罗)定律等等。 如果气体分子动理论所提出的关于分子运动的模型以及由此而导出的气体 分子运动公式是对的,则它应该经得起实践的考验,能够对这些经验规律给以说 明。 l.Boyle-Marriote定律 将式(1.10)写作 pV=合m2,N.号 对于一定量的气体,在定温下,N和m2均为定值,所以上式可写作 pV=C (1.11) 式中C是常数。这就是Boyle-Marriote定律,即定温下一定量的气体,其体积 与压力成反比。这个定律最初是在低压下由实验所总结出来的经验规律。 2.Charles-Gay-Lussac定律 我们已知温度越高,分子的平均平动能也越大。即 E=合mu2=f(T) 低压下实验表明V-t(摄氏温度)具有线性关系,根据气体分子动理论,V= 寻m2,故而可得分子的平动能与t也具有线性关系。由于二者是平行关系, 我们可以选择一种温标,使二者的关系是线性关系。设温度在0℃和t时平均平 动能分别是E。和E,则 E.=E.o(1+at) (1.12) 根据气体分子动理论的公式,在0℃和时, V=苏Nm旺=品vE 一3分Nmu=是NE 根据式(1.12),V,和V。之间应有如下的关系 V,=V(1+a) 式中。就是体膨胀系数

文61气体分子动理跑17 令 T=+ (1.13) 则 V:=VoTa =C'T 式中C为常数。即对定量的气体,在定压下,体积和T成正比,这就是Charles 定律。Charles和Gay-Lussac分别在1787年和1802年从实验总结出这条定 律,所以也叫做Charles-Gay-Lussac定律。 3.Avogadro定律 任意两种气体当温度相同时,具有相等的平均平动能 是mG=2m: 从分子运动公式 aV,=号N,m好=号N(合mi) pV:=}Nm暖=号N,(2m:) 因此在同温、同压下,同体积的气体应有 N1=N2 (1.14) 即同温同压下,同体积的各种气体所含有的分子个数相同,这就是Avogadro定 律。 4.理想气体的状态方程式 既然我们已经由气体分子的运动模型导出了上面三个定律,则合并后就可 得到理想气体的状态方程式,V=RT。气体的体积随压力、温度以及气体分 子的数量而变,写成函数的形式是 V f(p,T,N) 多 dv=(影)dp+()r+(别)ndN 对于一定量的气体,N为常数,dN=0,所以, V-()d()T 根据Boyle-Marriote定律, v-8有(0。=-号=-吕 根据Charles-Gay-Lussac定律

18 v-CT有()=C=号 代入上式后得 dv=-dp+¥dr或Y=-半+平 上式积分得 lnV+lnp=lnT+常数 若所取气体的量是1mol,则体积写作Vm,常数写作R,即得 pV=RT 上式两边同乘以物质的量,则得 PV nRT 这就是理想气体的状态方程式。已知n=》N是分子的个数,L是Avogadre0 常。数令:尽=a,u称为Bo(玻耳兹曼)常数,则上式又可写作。 pV NknT (1.15) 5.Dalton分压定律 若在定温下,把几种不同的气体混合于容积为V的容器中,各种分子的数 目分别为N,N2,.,总分子数为N1+N2十.=N。混合气体可设想是通过 如下的混合过程来完成, T.V T.V T.V NiP N.N:.N N:P: 混合前, A=N,m赋=号YE A=N,m暖=号兰E . 诸式相加, ∑p,=品[NE+N,E+.] 混合后, p=3N m.Eai

攻雪11气体分子动理论9 由于相同温度下,各气体分子具有相同的平均动能,即 E1=E2=.=E 而 Nm=N+N,+. 所以 p=p十十. (1.16) 这就是Dalton分压定律(Dalton's law of partial pressure),即混合气体的 总压等于各气体分压之和。所谓分压,就是在同一温度下,各别气体单独存在、 并占有与混合气体相同体积时所具有的压力。 若任一种气体的分压除以总压,则得 Nm 3 或 = 式中x是摩尔分数。这是Dalton分压定律的另一种形式。 6.Amagat(阿马格)分体积定律 在一定的T,p时,混合气体的体积等于组成该混合气体的各组分的分体积 之和,即 V=V1+V2+. 这就是Amagat分体积定律(Amagat's law of partial volume),所谓某一组 分的体积,它等于该气体在温度T和总压p时单独存在时所占据的体积。 设有两种气体的混合过程如下图所示, V T.P.N T.P.N, T,p,(N,+N) V:=V+V2 由此并可导出 Vi=Vz. (1.17) 根据气体的运动公式,不难导出Amagat分体积定律(读者试自证之)。 由式(1.17)可知,在混合气体中各气体的体积分数就等于它的摩尔分数。 (在工业分析中经常使用的气体分析仪,就使用了这一定律) 分子平均平动能与温度的关系 已知气体分子的平均平动能是温度的函数,即
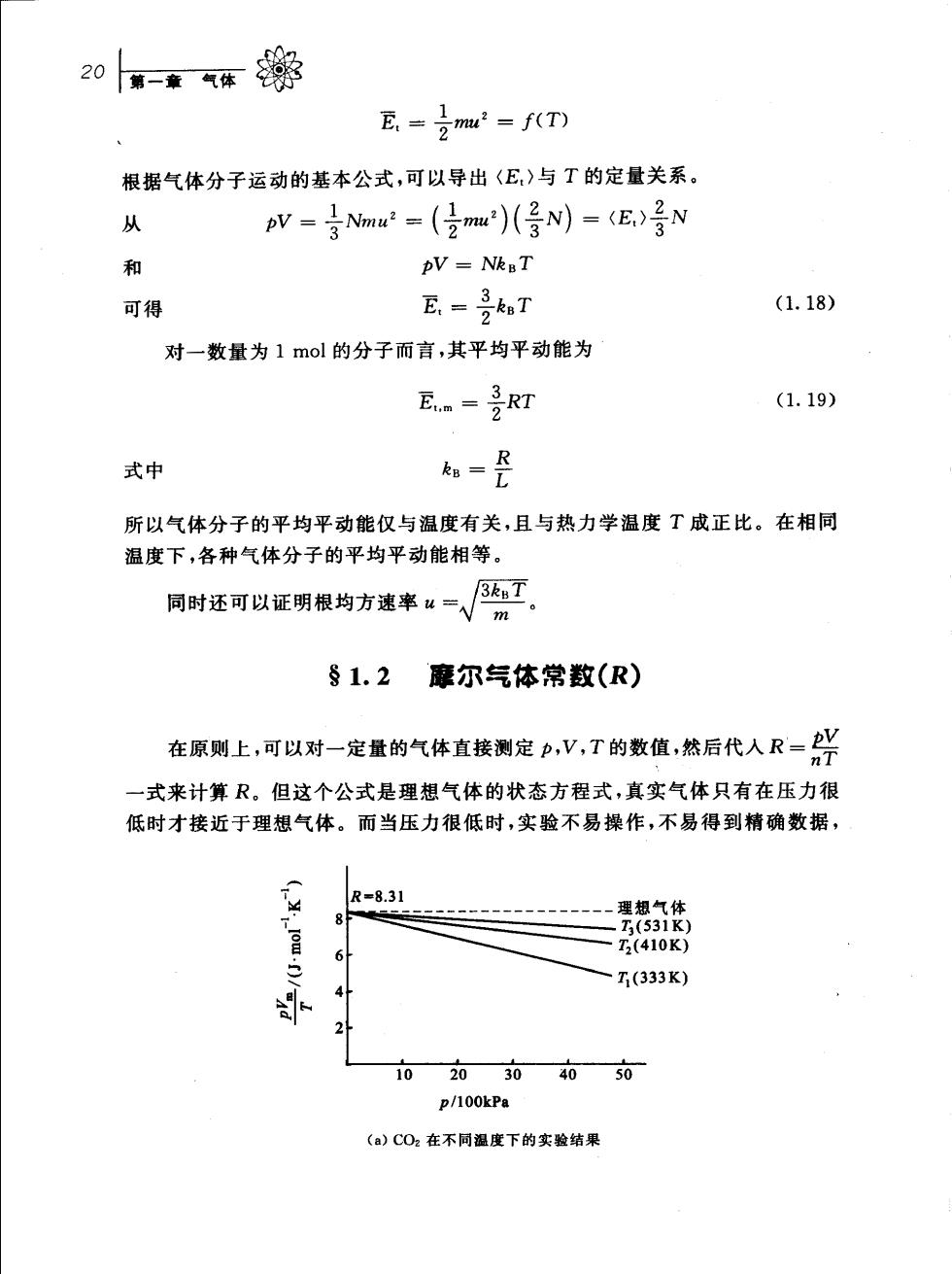
20-索气华静 E.=imu=f(T) 根据气体分子运动的基本公式,可以导出〈E)与T的定量关系。 从 pv=号Nmw2=(2mu)(号N)=〈E,)号N 和 AV NkgT 可得 E=号T (1.18) 对一数量为1mol的分子而言,其平均平动能为 EmRT (1.19) 式中 h 所以气体分子的平均平动能仅与温度有关,且与热力学温度T成正比。在相同 温度下,各种气体分子的平均平动能相等。 同时还可以证根均方率一√ §1.2 廉尔气体常数(R) 在原则上,可以对一定量的气体直接测定p,V,T的数值,然后代入R=兴 一式来计算R。但这个公式是理想气体的状态方程式,真实气体只有在压力很 低时才接近于理想气体。而当压力很低时,实验不易操作,不易得到精确数据, R=8.31 -理想气体 T7(333K) 4” 21 102030 4050 p/100kPa (a)CO2在不同温度下的实骏结果