
k=Ae-E,/RT Ink=- +In A RT ·如果Arrhenius的假设合理,则实 验数据k~T服从Arrhenius方程; ·即所得的实验曲线:lnk~1/T应为 一条直线,直线斜率为-E/R,截 距为nA
• 如果 Arrhenius 的假设合理,则实 验数据k T服从Arrhenius 方程; • 即所得的实验曲线:ln k 1/T应为 一条直线,直线斜率为 Ea /R,截 距为lnA。 Ea / RT k Ae ln A RT E lnk a
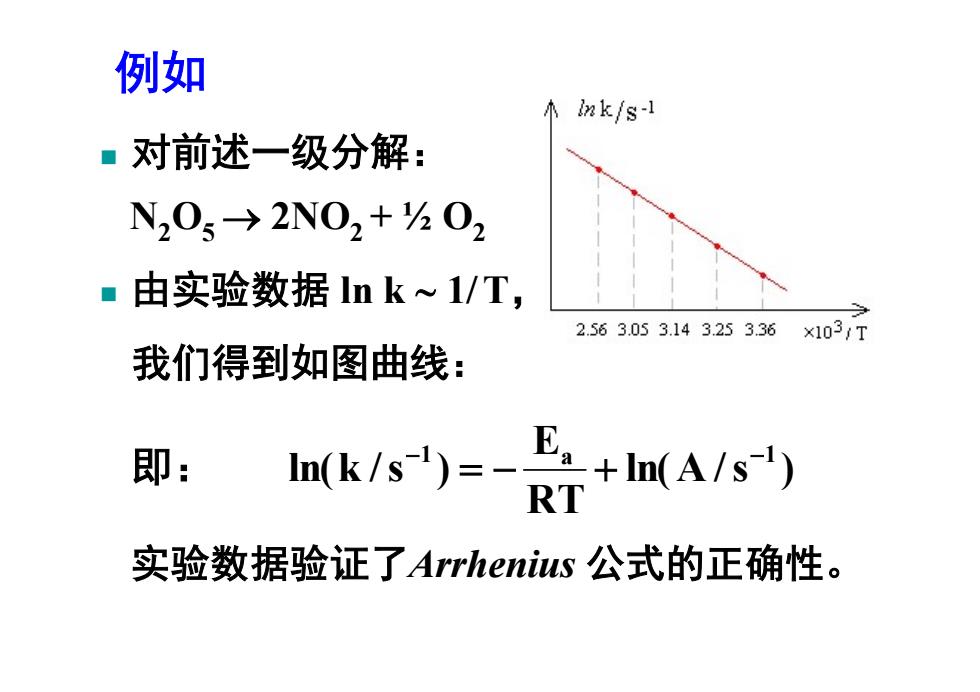
例如 小mk/s-l ■对前述一级分解: N205→2N02+h02 ■由实验数据lnk心1/T, 2.563.053.143.253.36×1031T 我们得到如图曲线: 即: n(k/s)=- E.+I(A/s') R 实验数据验证了Arrhenius公式的正确性
对前述一级分解: N2O5 2NO2 + ½ O2 由实验数据 ln k 1/ T, 我们得到如图曲线: ln( A /s ) RT E ln(k /s ) 1 a 1 即: 例如 实验数据验证了Arrhenius 公式的正确性
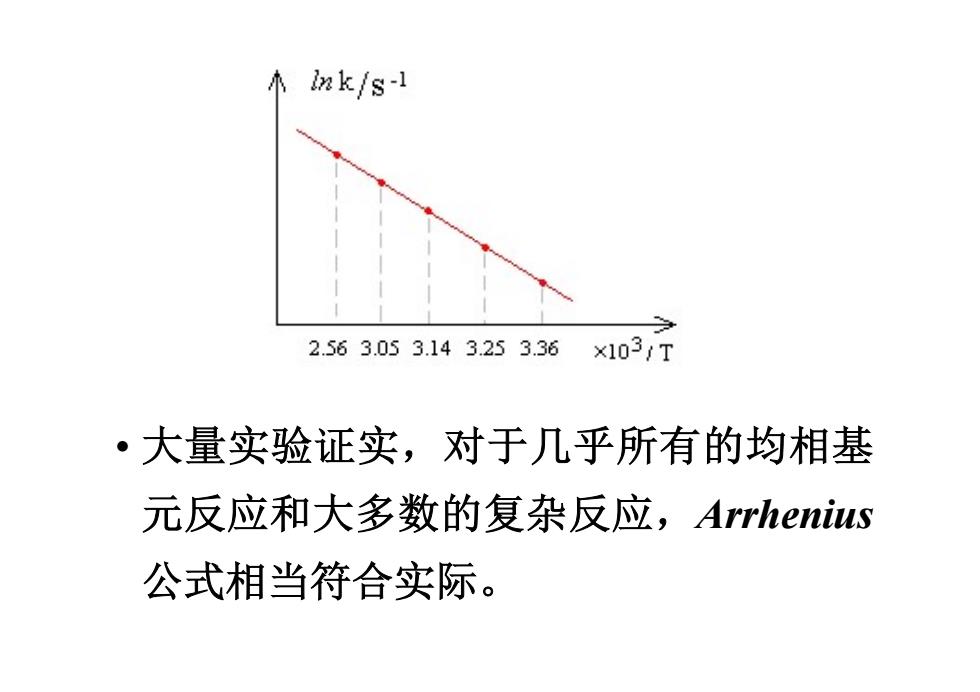
ak/s1 2.563.053.143.253.36 ×1031T ·大量实验证实,对于几乎所有的均相基 元反应和大多数的复杂反应,Arrhenius 公式相当符合实际
• 大量实验证实,对于几乎所有的均相基 元反应和大多数的复杂反应,Arrhenius 公式相当符合实际

讨论 ·Arrhenius方程 E lnk=、 E2+InA RT 在数学形式上稍有欠缺,其原因在于我们 只能对无量纲数(如Ke、K⊙)取对数, 但k有量纲; ■对于一级反应,k的单位是S1,A的单位 也是s1;
讨论 • Arrhenius 方程: ln A RT E lnk a 在数学形式上稍有欠缺,其原因在于我们 只能对无量纲数(如 KP 、Kc )取对数, 但 k 有量纲; 对于一级反应,k的单位是s 1 ,A的单位 也是 s 1 ;

■所以一级反应的Arrhenius方程的量纲 正确形式为: n(k/s)= E,+ln(A/s-内 ■不同的反应级数,其量纲正确表达式稍 有不同(需除去k的单位)
所以一级反应的 Arrhenius 方程的量纲 正确形式为: ( 1 ) a ln(A /s 1 ) RT E ln k /s 不同的反应级数,其量纲正确表达式稍 有不同(需除去 k 的单位)