
反应速率k与活化能E的关系 一、活化能定义 ·在Arrhenius经验式中: k=A·eE/RT (A和E,都当作常数) ·而进一步的研究(下一章的理论推导)可 以得到一个与经验式类似的方程,但此时 A和E,都与温度有关
反应速率k与活化能Ea 的关系 一、活化能定义 • 在 Arrhenius 经验式中: Ea / RT k A e (A和 Ea 都当作常数) • 而进一步的研究(下一章的理论推导)可 以得到一个与经验式类似的方程,但此时 A和 Ea 都与温度有关

实验证明: 当E>RT(大多数化学反应如此), E、A受温度的影响很小,即可认为 Ea、A是常数; ·当反应的温度范围较宽,或对于较复 杂的反应,则: 1 曲线就不是一条很好的直线,说明E,与 温度有关
实验证明: • 当 Ea RT(大多数化学反应如此), Ea 、A 受温度的影响很小,即可认为 Ea 、A是常数; • 当反应的温度范围较宽,或对于较复 杂的反应,则: 曲线就不是一条很好的直线,说明 Ea 与 温度有关。 T 1 lnk ~
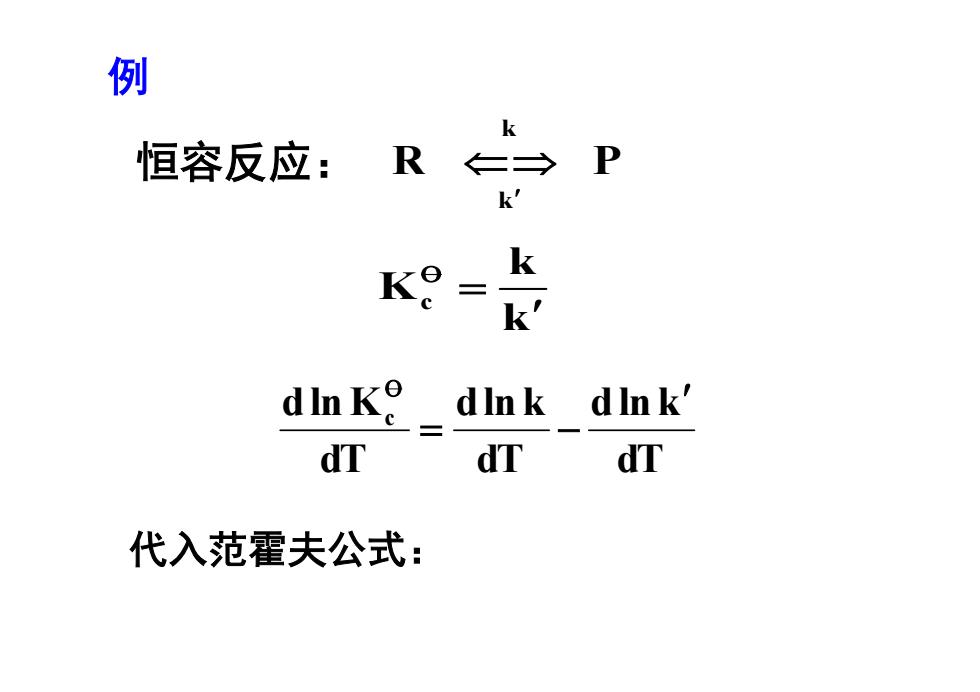
例 恒容反应:R ←→ P k K k k' dInK_ dInk dInk' dT dT dT 代入范霍夫公式:
恒容反应: k k Kc R P k k dT dln k dT dln k dT dln Kc 代入范霍夫公式: 例

△U9 dInk dInk' RT2 dT dT _dT Ea」 E RT2 RT2 → Qy=△U8=Ea-E 可用反证法证明E,与T有关:
dT dln K RT U c 2 m 2 a 2 a RT E RT E dT dlnk dT dlnk QV Um Ea Ea 可用反证法证明 Ea 与 T 有关:

Qy=△Ua=Ea-EA [反证法]证明E,与T有关: ■若E,与T无关(Arrhenius假设),则恒 容反应热效应Qy与温度T无关; ■但事实上,根据热力学,恒容热效应Qy 是温度的函数; ■所以严格地讲,E、E'也是温度的函数
[反证法] 证明 Ea 与T 有关: 若 Ea 与 T 无关(Arrhenius 假设),则恒 容反应热效应QV 与温度T 无关; 但事实上,根据热力学,恒容热效应 QV 是温度的函数; 所以严格地讲,Ea 、Ea 也是温度的函数。 QV Um Ea Ea