
2.2气体吸收的相平衡关系 2.2.1气体在液体中的溶解度 在一定温度和压强下,当气体混合物与一定量的液体吸收剂 接触时,溶质组分便不断进入液相中,这一过程称为溶解即吸收。 而同时已被溶解的溶质也将不断摆脱液相的束缚重新回到气相, 该过程称为解吸。这两个过程互为逆过程并具有各自的速率,当 气液两相经过长时间的接触后,溶质的溶解速率与解吸速率达到 相等时,气液两相中溶质的浓度就不再因两相间的接触而变化, 这种状态称为相际动平衡,简称相平衡或平衡。 平衡状态下气相中的溶质分压称为平衡分压或饱和分压,液 相中的溶质组成称为平衡组成或饱和组成。 气体在液体中的溶解度,是指气体在液体中的饱和组成,常 以单位质量或体积的液体所含溶质的质量来表示。 气体的溶解度标明一定条件下吸收过程可能达到的极限程度
2.2 气体吸收的相平衡关系 2.2.1 气体在液体中的溶解度 在一定温度和压强下,当气体混合物与一定量的液体吸收剂 接触时,溶质组分便不断进入液相中,这一过程称为溶解即吸收。 而同时已被溶解的溶质也将不断摆脱液相的束缚重新回到气相, 该过程称为解吸。这两个过程互为逆过程并具有各自的速率,当 气液两相经过长时间的接触后,溶质的溶解速率与解吸速率达到 相等时,气液两相中溶质的浓度就不再因两相间的接触而变化, 这种状态称为相际动平衡,简称相平衡或平衡。 平衡状态下气相中的溶质分压称为平衡分压或饱和分压,液 相中的溶质组成称为平衡组成或饱和组成。 气体在液体中的溶解度,是指气体在液体中的饱和组成,常 以单位质量或体积的液体所含溶质的质量来表示。 气体的溶解度标明一定条件下吸收过程可能达到的极限程度
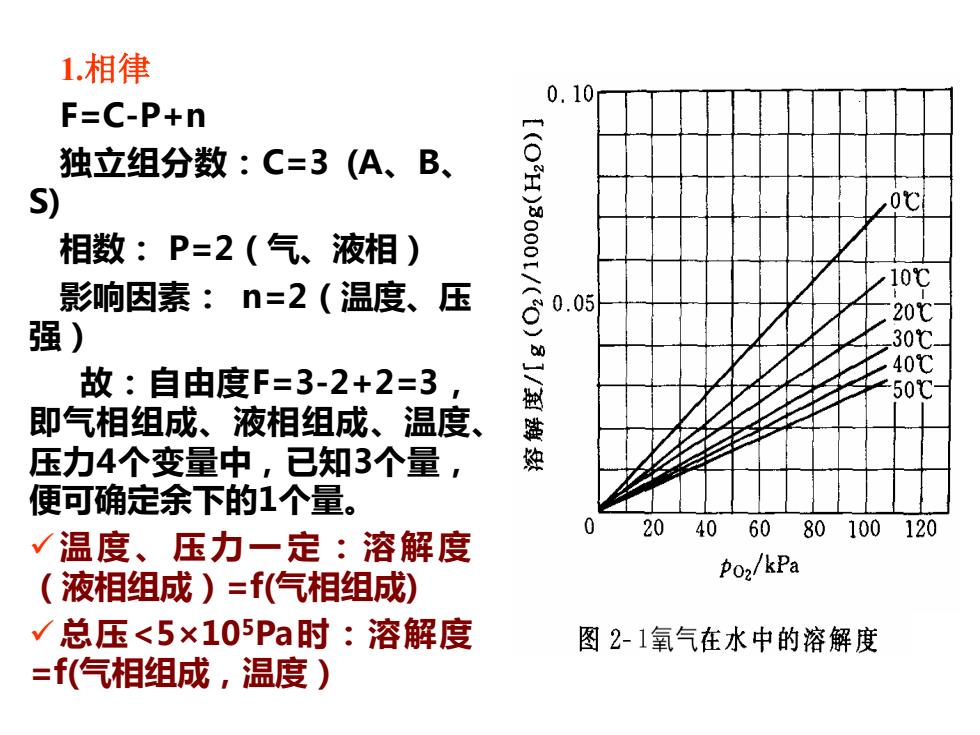
1.相律 0.10 F=C-P+n 独立组分数:C=3(A、B、 S) 相数:P=2(气、液相) [(OH)0001/( ,0℃ 影响因素:n=2(温度、压 强) g0.0l 故:自由度F=3-2+2=3 40℃ 50℃ 即气相组成、液相组成、温度、 压力4个变量中,已知3个量 便可确定余下的1个量。 0 20406080100120 √温度、压力一定:溶解度 (液相组成)=(气相组成) Po2/kPa √总压<5×105Pa时:溶解度 图2-1氧气在水中的溶解度 =f(气相组成,温度)
1.相律 F=C-P+n 独立组分数:C=3 (A、B、 S) 相数: P=2(气、液相) 影响因素: n=2(温度、压 强) 故:自由度F=3-2+2=3, 即气相组成、液相组成、温度、 压力4个变量中,已知3个量, 便可确定余下的1个量。 ✓温 度、压 力 一 定 : 溶 解 度 (液相组成)=f(气相组成) ✓总压<5×105Pa时:溶解度 =f(气相组成,温度)
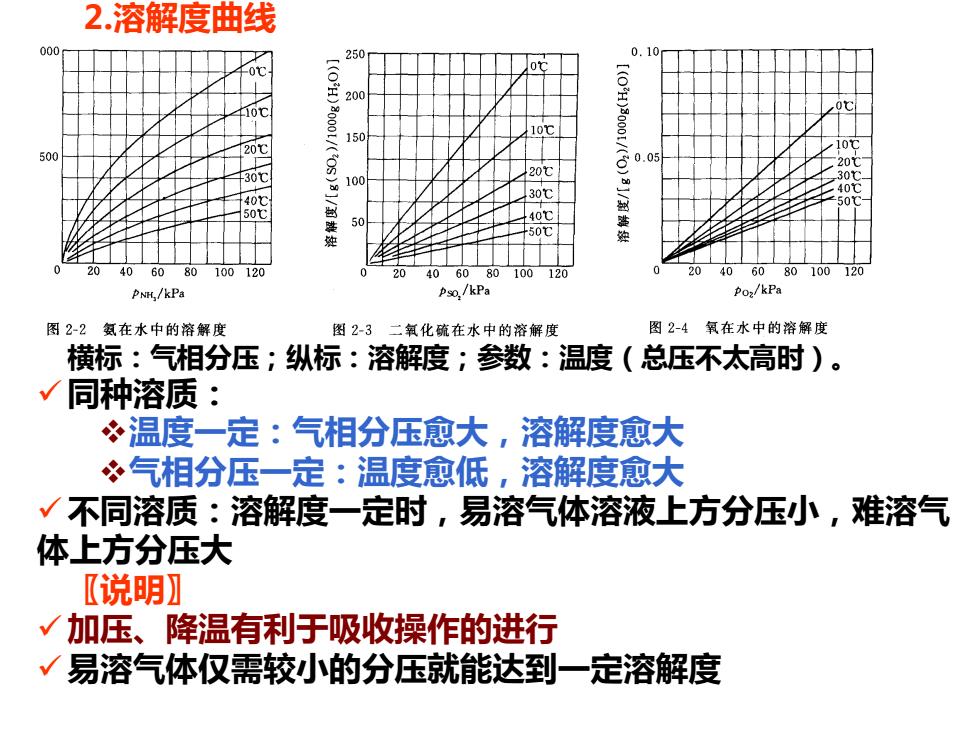
2.溶解度曲线 000 250 0.10 00 20 10℃ 150 10℃ 500 20℃ 30℃ 100 20℃ 40 30℃ 50t (0H)400g口/(V)5)9高牌盘热然 (0iaa00/()al/制换 So 40℃ 50℃ 406080100120 40 60 80 100120 20 406080100 120 PNH,/kPa Pso,/kPa Poz/kPa 图2-2氨在水中的溶解度 图23二氧化疏在水中的溶解度 图2-4氧在水中的溶解度 横标:气相分压;纵标:溶解度;参数:温度((总压不太高时)。 √同种溶质: ÷温度一定:气相分压愈大,溶解度愈大 ?气相分压一定:温度愈低,溶解度愈大 √ 不同溶质:溶解度一定时,易溶气体溶液上方分压小,难溶气 体上方分压大 〖说明】 √加压、降温有利于吸收操作的进行 √易溶气体仅需较小的分压就能达到一定溶解度
2.溶解度曲线 横标:气相分压;纵标:溶解度;参数:温度(总压不太高时)。 ✓同种溶质: ❖温度一定:气相分压愈大,溶解度愈大 ❖气相分压一定:温度愈低,溶解度愈大 ✓不同溶质:溶解度一定时,易溶气体溶液上方分压小,难溶气 体上方分压大 〖说明〗 ✓加压、降温有利于吸收操作的进行 ✓易溶气体仅需较小的分压就能达到一定溶解度

2.2.2亨利定律 随着对相平衡关系的研究,发现很多气体在浓度较小时其溶 解度曲线为通过坐标原点的直线,这一规律用亨利(Henry)定 律进行描述。 1.pe=Ex 称为吸收过程的相平衡方程一 亨利定律。 式中:P。一溶质A在气相中的平衡分压,kPa; X一溶质A在液相中的摩尔分率; E一亨利系数,kPa。 表明:当总压不高(<0.5MPa)时,在一定温度下气液两相 达到平衡时,稀溶液上方气相中溶质的平衡分压与液相中溶质 的摩尔分率成正比
2.2.2 亨利定律 随着对相平衡关系的研究,发现很多气体在浓度较小时其溶 解度曲线为通过坐标原点的直线,这一规律用亨利(Henry)定 律进行描述。 1. pe=Ex 称为吸收过程的相平衡方程 —— 亨利定律。 式中: pe— 溶质A在气相中的平衡分压,kPa x —— 溶质A E —— 亨利系数,kPa。 表明:当总压不高(<0.5MPa)时,在一定温度下气液两相 达到平衡时,稀溶液上方气相中溶质的平衡分压与液相中溶质 的摩尔分率成正比

〖说明〗 √理想溶液:拉乌尔定律: p。=px.E=pA √非理想溶液: E≠pA √低浓度气体吸收:E=常量 √难溶物系:E≠常量,但当P<0.1MPa时,E可视为常量 √P<0.1MPa时,E=f(t);P>0.1MPa时,E=f(Pt) √E由实验测定确定:以P。对作图,当X一→0,P。的值即 为E。常见物系的E可查有关手册。 √对于一定的气体和一定的溶剂,E值随温度变化:t↑,E↑, 心,体现气体溶解度随温度升高而减小的变化趋势。 同一溶剂中: 冬易溶气体的E值很小 冬难溶气体的E值相对较大
〖说明〗 ✓理想溶液:拉乌尔定律: ✓非理想溶液: ✓低浓度气体吸收:E=常量 ✓难溶物系:E≠常量,但当P<0.1MPa时,E可视为常量 ✓P<0.1MPa时,E=f(t);P>0.1MPa时,E=f(P,t) ✓E由实验测定确定:以pe/x对x作图,当x→0, pe/x的值即 为E。常见物系的E可查有关手册。 ✓对于一定的气体和一定的溶剂,E值随温度变化:t↑,E↑, x↓,体现气体溶解度随温度升高而减小的变化趋势。 ✓同一溶剂中: ❖易溶气体的E值很小 ❖难溶气体的E值相对较大。 e A A p = p x E = p A E p