
那 标准溶液的配制与标定
标准溶液的配制与标定

NaOH标准溶液的配制与标定 目的 1、掌握NaOH标准溶液的配制、保存方法 2、进一步学习天平、容量器皿(滴定管、移液 管、容量瓶等)的使用. 3、掌握酚酞指示剂确定终点的方法。 4、学习NaOH标准溶液的标定方法 5、 了解邻苯二甲酸氢钾的性质与应用
NaOH标准溶液的配制与标定 目的 1、掌握NaOH标准溶液的配制、保存方法 2、进一步学习天平、容量器皿(滴定管、移液 管、容量瓶等)的使用. 3、掌握酚酞指示剂确定终点的方法。 4、学习 NaOH标准溶液的标定方法 5、了解邻苯二甲酸氢钾 的性质与应用

原理 由于NaOH固体易吸收空气中的 C0,和水分,故只能选用标定法(间 接法)来配制,即先配成近似浓度的 溶液,再用基准物质或已知准确浓 度的标准溶液标定其准确浓度。通 常配制0.1moL1的溶液。 圈 图
由于NaOH固体易吸收空气中的 CO2和水分,故只能选用标定法(间 接法)来配制,即先配成近似浓度的 溶液, 再用基准物质或已知准确浓 度的标准溶液标定其准确浓度。通 常配制0.1mol·L-1的溶液。 原理

原理 标定:用基准物质准确标定出NaOH溶液的 浓度 常用基准物质:邻苯二甲酸氢钾,草酸 (1)邻苯二甲酸氢钾: 优点:易制得纯品,在空气中不吸水,易 保存,摩尔质量大,与NaOH反应的计量比 为1:1。在100~125°℃下干燥12h后使用 晶 國 制
原理 ▪ 标定:用基准物质准确标定出NaOH溶液的 浓度 ▪ 常用基准物质:邻苯二甲酸氢钾,草酸 ▪ (1) 邻苯二甲酸氢钾: ▪ 优点:易制得纯品,在空气中不吸水,易 保存,摩尔质量大,与NaOH反应的计量比 为1:1。在100~125℃下干燥1~2h后使用
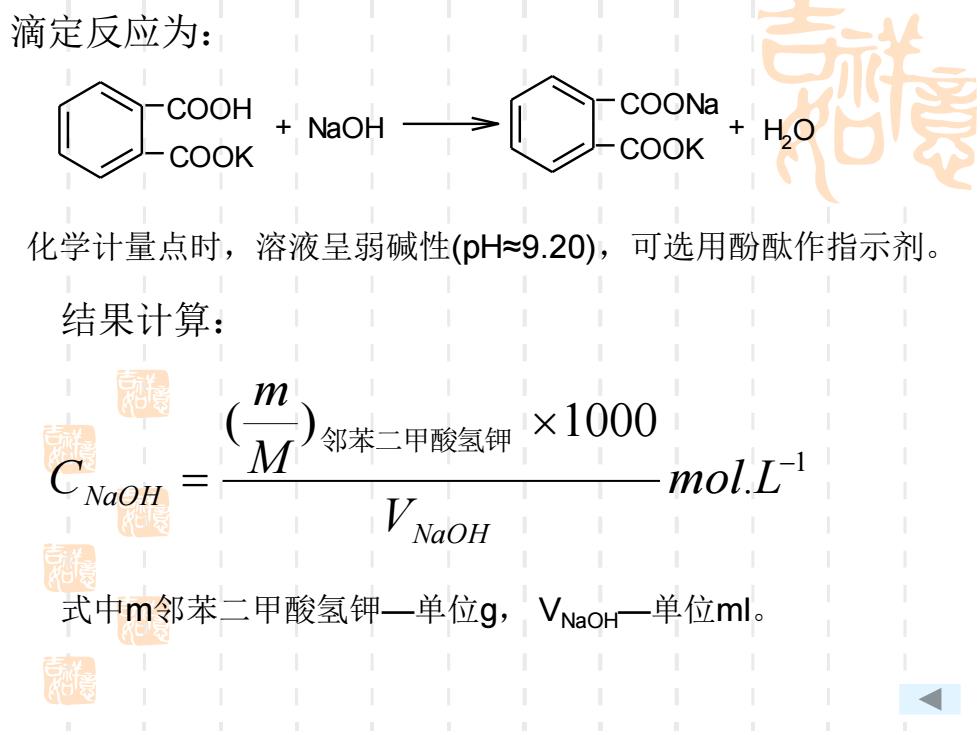
滴定反应为: COOH COONa NaOH +H0 COOK COOK 化学计量点时,溶液呈弱碱性(pH9.20),可选用酚酞作指示剂。 结果计算: 邻苯二甲酸氢钾 ×1000 NaOH mol.L VNaOH 式中m邻苯二甲酸氢钾一单位g,VNao一单位ml
COOH COOK + NaOH COOK COONa + H2 O 滴定反应为: 1 . ( ) 1000 − = mol L V M m C NaOH NaOH 邻苯二甲酸氢钾 式中m邻苯二甲酸氢钾—单位g, VNaOH—单位ml。 化学计量点时,溶液呈弱碱性(pH≈9.20),可选用酚酞作指示剂。 结果计算: