
4.2 反应速率理论简介 Brief introductory to reaction rate theory 4.2.1 碰撞理论 Collision theory 4.2.2 过渡状态理论 Transition state theory 4.2.3 活化能E,Activation energy 上页下页目录返回
4.2 反应速率理论简介 Brief introductory to reaction rate theory 4.2.1 碰撞理论 Collision theory 4.2.2 过渡状态理论 Transition state theory 4.2.3 活化能 Ea Activation energy

反应速率理论 Reaction rate theory 4.2.1碰撞理论 1918年Lewi心以气体分子运动论为基础提出。 对于反应 O3(g)+NO(g)>NO2 (g)+2(g) v=kc(NO)c(O3) 发生有效碰撞的两个基本前提: ● 碰撞粒子的动能必须足够大 对有些物种而言,碰撞的几何方位要适当 上页 下页 目录返回
1918年 Lewis以气体分子运动论为基础提出。 发生有效碰撞的两个基本前提: ● 碰撞粒子的动能必须足够大 ● 对有些物种而言,碰撞的几何方位要适当 O (g) NO(g) NO (g) O (g) 3 2 2 (NO) (O ) 3 ν kc c 对于反应 4.2.1 碰撞理论

对于反应 C0 N0+O一C一O 113pm 115pm 116pm 活化络合物 (过渡态) (a) (b) (d) 上页下页目录返回
对于反应 O N O + C O O N O C O N O + O C O 118pm 113pm 115pm 116pm 活化络合物 (过渡态)
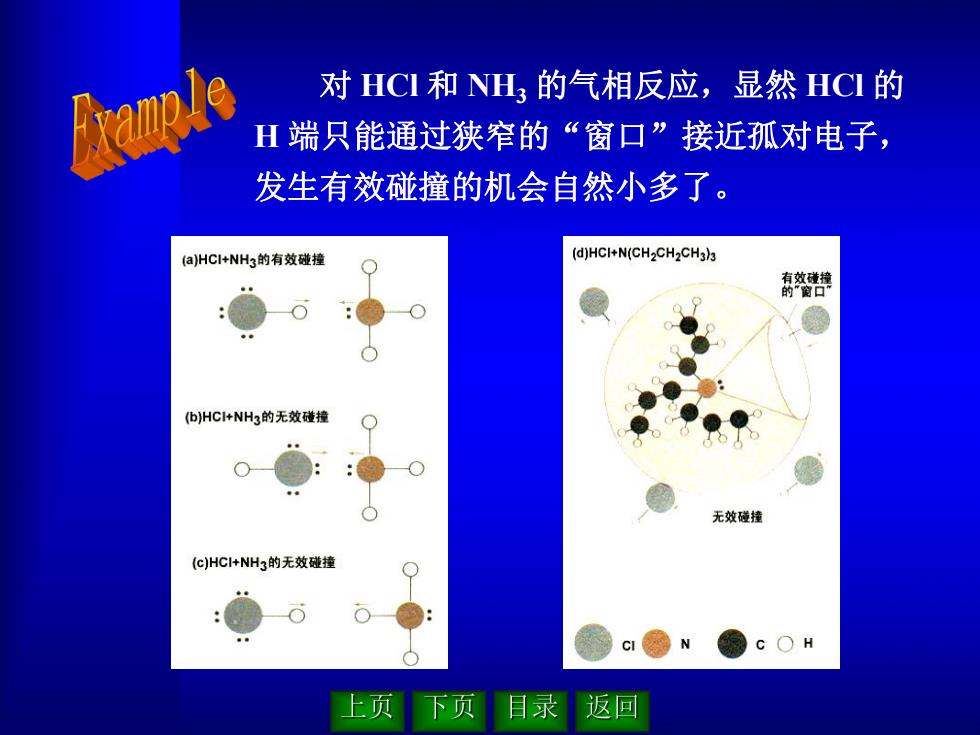
对HCI和NH3的气相反应,显然HCI的 H端只能通过狭窄的“窗口”接近孤对电子, 发生有效碰撞的机会自然小多了。 (a)HCI+NHs的有效碰撞 (d)HCI+N(CH2CH2CH3)3 南效 (bHC+NH3的无效碰撞 无效碰撞 (c)HCl+NH3的无效碰撞 c H 上页 返回
对 HCl 和 NH3 的气相反应,显然 HCl 的 H 端只能通过狭窄的“窗口”接近孤对电子, 发生有效碰撞的机会自然小多了

2 对应2HⅡH2+12,若每次碰撞都反应, T=500℃,c(HI=1.0×10-3 mol-dm-1,d(HI) 4.0×10-10m。则理论碰撞次数和实际碰 撞次数各为多少? Solution E v=ZPf=Z Pe RT 这里,Z一 碰撞总数 P一 取向因子 以碰撞频率公式计算: f 能量因子 Z=2N"d" =4.6×1028次.dm-1.s- 则y=7.6×10 mol dm.s 实际反应速率仅为1.2×10-8 mol-dm-1s-1,两者相差1012倍。 上页下页目录返回
对应2HI H2+I2,若每次碰撞都反应, T=500℃,c(HI)=1.0×10 –3mol·dm-1 , d (HI) = 4.0×10 –10m。则理论碰撞次数和实际碰 撞次数各为多少? 实际反应速率仅为1.2×10-8mol·dm-1 ·s -1,两者相差1012倍。 28 1 1 2 2 4.6 10 dm s 2 次 M RT Z N d 则 4 1 1 7.6 10 mol dm s Question 2 以碰撞频率公式计算: RT Ea Z P f Z P e 这里,Z 碰撞总数 P 取向因子 f 能量因子 Solution