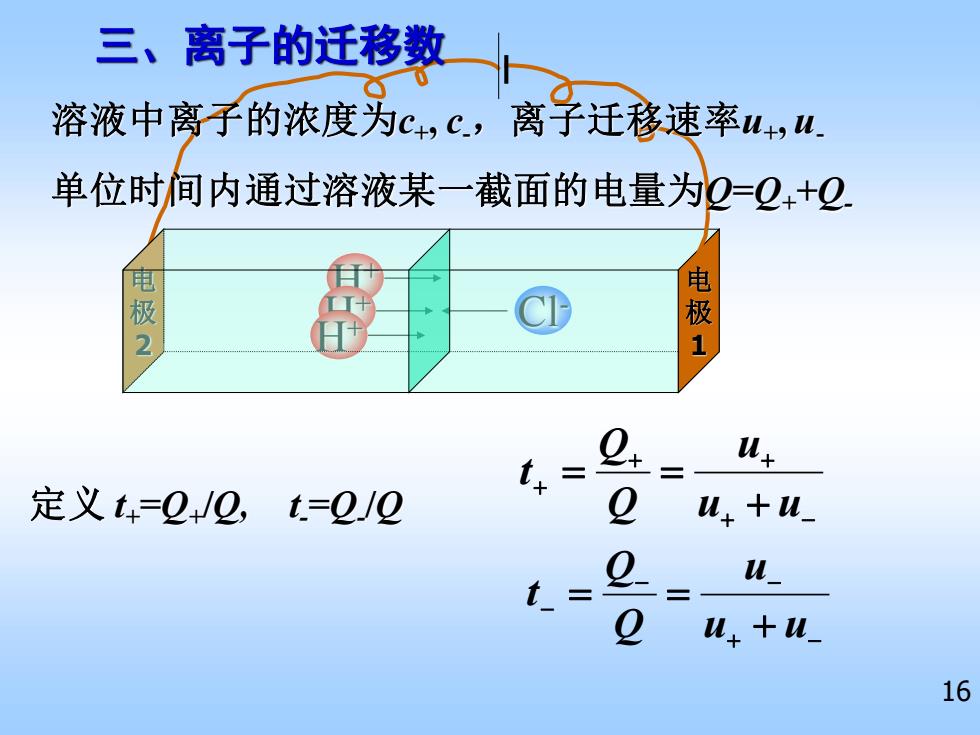
三、离子的迁移数 溶液中离子的浓度为c,c,离子迁移速率W+,u 单位时间内通过溶液某一截面的电量为2=+2 电 电 2 1 t+= 定义t4=2+/2,t=2/№ 2 M++W_ t= u u.+u 16
16 电 极 2 H+ 三、离子的迁移数 Cl- 定义 t+=Q+ /Q, t -=Q- /Q + − + + + + = = u u u Q Q t + − − − − + = = u u u Q Q t H+ H+ 电 极 1 单位时间内通过溶液某一截面的电量为Q=Q++Q- 溶液中离子的浓度为c+ , c-,离子迁移速率u+ , u-
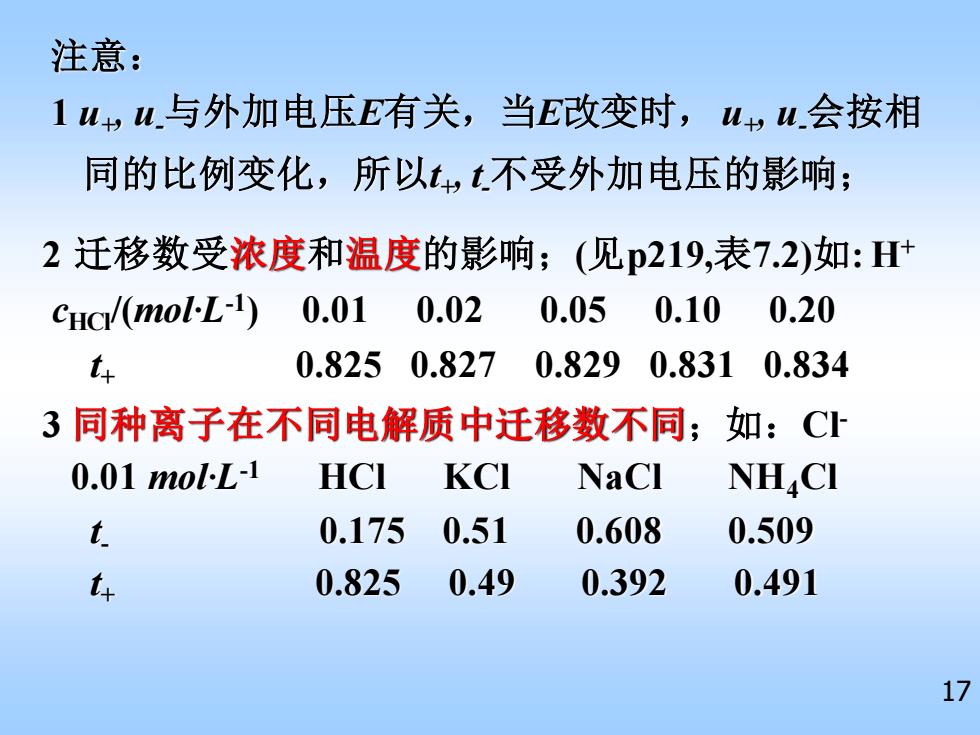
注意: 1w,w与外加电压E有关,当E改变时,uw会按相 同的比例变化,所以tt不受外加电压的影响; 2迁移数受浓度和温度的影响;(见p219,表7.2)如:H+ CHc/(molL-1) 0.01 0.02 0.050.10 0.20 t 0.8250.827 0.829 0.8310.834 3同种离子在不同电解质中迁移数不同;如:C 0.01molL-1 HCI KCI NaCl NH.CI t 0.175 0.51 0.608 0.509 t 0.825 0.49 0.392 0.491 17
17 1 u+ , u-与外加电压E有关,当E改变时, u+ , u-会按相 同的比例变化,所以t+ , t -不受外加电压的影响; 注意: 3 同种离子在不同电解质中迁移数不同;如:Cl- 0.01 mol·L-1 HCl KCl NaCl NH4Cl t - 0.175 0.51 0.608 0.509 t+ 0.825 0.49 0.392 0.491 2 迁移数受浓度和温度的影响;(见p219,表7.2)如: H+ cHCl/(mol·L-1 ) 0.01 0.02 0.05 0.10 0.20 t+ 0.825 0.827 0.829 0.831 0.834

§7.2电解质溶液的电导 一、 电导G、电导率x、摩尔电导率4m 二、电导的测定:电阻R→电导G→电导率K 三、电导率和摩尔电导率随浓度的变化 四、离子独立运动定律 18
18 §7.2 电解质溶液的电导 一、电导G、电导率 、摩尔电导率m 二、电导的测定: 电阻R→电导G →电导率 三、电导率和摩尔电导率随浓度的变化 四、离子独立运动定律

一、电导G、电导率K、摩尔电导率Am 电阻:R=pLA) 单位:2 电阻率:p=R(A/) Ωm 1电导:G=1R S(西门子) 2电导率:1/pGUA) S.ml 其中(WA=电导池常数Kl 物理意义):电极面积各为1m2,两电极相距1m 时溶液的电导。 的数值与电解质种类、温度、浓度有关 19
19 一、电导G、电导率 、摩尔电导率m 电阻:R=(l /A) 单位: 电阻率: = R(A / l) m 1 电导:G = 1/R S(西门子) 2 电导率: = 1/=G(l /A) Sm-1 其中 (l/A)=电导池常数Kcell (物理意义):电极面积各为1m2 , 两电极相距1m 时溶液的电导。 的数值与电解质种类、温度、浓度有关
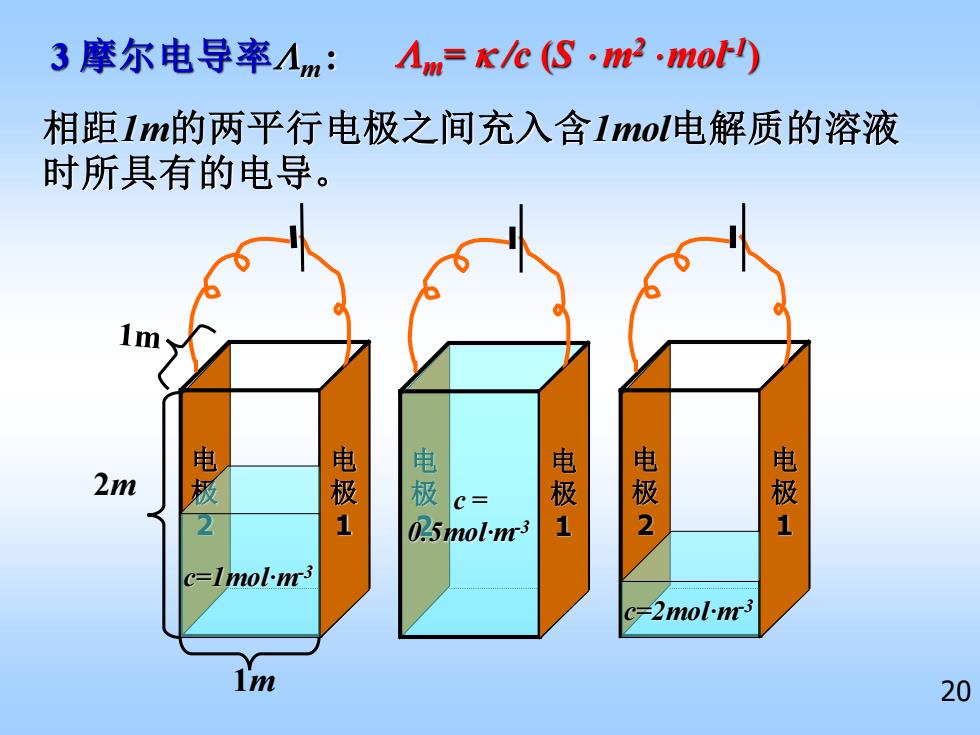
3摩尔电导率人m:人mKe(S·m2.mot) 相距1m的两平行电极之间充入含lmo电解质的溶液 时所具有的电导。 电 电 电 电 2m c= 电极 电极 2 1 025mol-n3 1 c=Imol-n3 c-2mol-m3 m 20
20 相距1m的两平行电极之间充入含1mol电解质的溶液 时所具有的电导。 3 摩尔电导率m : 电 极 2 c=1mol·m-3 电 极 1 电 极 2 c = 0.5mol·m-3 电 极 1 电 极 2 c=2mol·m-3 电 极 1 m= /c (S m2 mol-1 ) 2m 1m