
食品技术原理课程讲稿-第九章食品分离加工 第 6 页 ,共 48 页 线上的点所对应的物系为饱和溶液。 E 点表示冰、固体溶质和溶液成平衡时的状态,称为最低共熔点。 曲线 AE 和 BE 的上方区域为溶液区域,曲线 AE 的下方为冰和溶液两相共存的 区域,而 BE 下方则为蔗糖和溶液两相共存的区域。 由图 10-3 可见,水溶液的冰点随着固体溶质的浓度增大而降低,而溶质的溶解 度随温度的增加而增大。冰、固体溶质和溶液三者的平衡温度只有一个,该温度 是冰和固体溶质共同熔化的温度,因而称为最低共熔点。最低共熔点时的浓度, 称为最低共熔浓度。 ①当溶液的浓度低于最低共熔浓度时,在状态点 1(浓度为 1 x ,温度为 1 )的 蔗糖水溶液,当温度降至 ' 1 时,溶液中的水开始结冰,即溶液中开始出现冰晶, ' 1 为该溶液的冰点。 ②如果温度继续下降至 '' 1 ,则原溶液将分成两部分:⑴以点 2 状态代表的 冰晶;⑵以状态点 3 代表的溶液,其浓度大于原溶液的浓度。此时,建立了以点 2 代表的固相(冰晶) 和以点 3 所代表的液相(溶液)的新的平衡。 温度继续下降,点 3 所代表的溶液的浓度继续增大,即溶液的浓度继续增大。 这就是冷冻浓缩的操作原理。 当溶液温度继续下降至最低共熔温度时,与冰晶成平衡的溶液为最低共熔点 E 所代表的溶液,所以以最低共熔浓度的状态点出发,通过冷却操作只能实现溶 液的浓缩而不能得到蔗糖结晶。 ③如果从浓度高于最低共熔浓度的状态点 2 开始冷却,则冷却至 ' 2 稳定时, 就开始有蔗糖晶体出现,随着温度进一步降低,体系便形成⑴为蔗糖晶体;⑵浓 度下降的溶液相的两相平衡体系,此时,温度下降越大,溶液的浓度下降也越 大,结晶出的蔗糖就越多。这就是冷却结晶的操作原理。 (三)过饱和溶液与过饱和系数 1、过饱和溶液:理论上,在任意温度下,溶液的浓度超过饱和浓度, 就有 溶质析出,但实际上,把不饱和溶液用冷却或浓缩的方法使其略呈过饱和状态, 一般并无结晶析出而成为过饱和溶液,只有达到某种程度的过饱和状态,才有晶 体析出。 2、不纯蔗糖溶液中蔗糖的溶解度用饱和系数 ' 表示: 0 ' 1 H H = 纯糖溶液溶解量 不纯糖液溶解的量 = 3、过饱和系数:过饱和程度的大小用过饱和系数来表示,符号: 。 H1 H = = 同温度下溶质相应饱和溶解量 过饱和溶液中单位溶剂所溶解的溶质的量 ①当 >1,表示溶液为过饱和溶液;其中
食品技术原理课程讲稿-第九章食品分离加工 第 6 页 ,共 48 页 线上的点所对应的物系为饱和溶液。 E 点表示冰、固体溶质和溶液成平衡时的状态,称为最低共熔点。 曲线 AE 和 BE 的上方区域为溶液区域,曲线 AE 的下方为冰和溶液两相共存的 区域,而 BE 下方则为蔗糖和溶液两相共存的区域。 由图 10-3 可见,水溶液的冰点随着固体溶质的浓度增大而降低,而溶质的溶解 度随温度的增加而增大。冰、固体溶质和溶液三者的平衡温度只有一个,该温度 是冰和固体溶质共同熔化的温度,因而称为最低共熔点。最低共熔点时的浓度, 称为最低共熔浓度。 ①当溶液的浓度低于最低共熔浓度时,在状态点 1(浓度为 1 x ,温度为 1 )的 蔗糖水溶液,当温度降至 ' 1 时,溶液中的水开始结冰,即溶液中开始出现冰晶, ' 1 为该溶液的冰点。 ②如果温度继续下降至 '' 1 ,则原溶液将分成两部分:⑴以点 2 状态代表的 冰晶;⑵以状态点 3 代表的溶液,其浓度大于原溶液的浓度。此时,建立了以点 2 代表的固相(冰晶) 和以点 3 所代表的液相(溶液)的新的平衡。 温度继续下降,点 3 所代表的溶液的浓度继续增大,即溶液的浓度继续增大。 这就是冷冻浓缩的操作原理。 当溶液温度继续下降至最低共熔温度时,与冰晶成平衡的溶液为最低共熔点 E 所代表的溶液,所以以最低共熔浓度的状态点出发,通过冷却操作只能实现溶 液的浓缩而不能得到蔗糖结晶。 ③如果从浓度高于最低共熔浓度的状态点 2 开始冷却,则冷却至 ' 2 稳定时, 就开始有蔗糖晶体出现,随着温度进一步降低,体系便形成⑴为蔗糖晶体;⑵浓 度下降的溶液相的两相平衡体系,此时,温度下降越大,溶液的浓度下降也越 大,结晶出的蔗糖就越多。这就是冷却结晶的操作原理。 (三)过饱和溶液与过饱和系数 1、过饱和溶液:理论上,在任意温度下,溶液的浓度超过饱和浓度, 就有 溶质析出,但实际上,把不饱和溶液用冷却或浓缩的方法使其略呈过饱和状态, 一般并无结晶析出而成为过饱和溶液,只有达到某种程度的过饱和状态,才有晶 体析出。 2、不纯蔗糖溶液中蔗糖的溶解度用饱和系数 ' 表示: 0 ' 1 H H = 纯糖溶液溶解量 不纯糖液溶解的量 = 3、过饱和系数:过饱和程度的大小用过饱和系数来表示,符号: 。 H1 H = = 同温度下溶质相应饱和溶解量 过饱和溶液中单位溶剂所溶解的溶质的量 ①当 >1,表示溶液为过饱和溶液;其中

食品技术原理课程讲稿-第九章食品分离加工 第 7 页 ,共 48 页 =1.0~1.2 属于介稳区,可使已有的晶体长大,并且有新的晶核形成。 加晶种、养晶核加一些助晶操作可控制在此介稳区域,又称育晶区; =1.2~1.3 属于中间区,不仅已有的晶体长大,同时也能有新的晶核 形成。刺激起晶常控制在此范围,同时在该区域也常产生伪晶。 >1.3 能自然起晶,晶核大量产生 ②当 =1,表示溶液为饱和溶液; ③当 <1,表示溶液为不饱和溶液,此时称为溶晶区,糖液不饱和,晶体 只能溶解,不能长大,在整理晶粒和伪晶(非起晶阶段形成的新的晶 核)时,过饱和控制在零的范围。 因此,要使结晶进行的先决条件是: >1 (四)晶核的形成 当可结晶溶质分子,在过饱和溶液中,分子的运动范围逐渐缩小,分子间的 吸引力大于排斥力,蔗糖便逐渐吸引,形成蔗糖分子的堆积点,缓缓形成晶核的 质点,并通过固晶使它继续长大,其大小达到具有晶体特性时,便称为晶核,它 在介稳区具有单独存在和继续长大的能力,这个晶核形成过程叫简称成核,也叫 起晶。 1、成核过程:在不含晶体的溶液中,由于溶质分子的热运动,即存在聚集 的可能,也存在着分散的可能,提高溶液的过饱和度或施予外界的作用,都能促 进溶质分子的聚集。晶核的形成是分子作有秩序地组合,按下列方式不断增长
食品技术原理课程讲稿-第九章食品分离加工 第 7 页 ,共 48 页 =1.0~1.2 属于介稳区,可使已有的晶体长大,并且有新的晶核形成。 加晶种、养晶核加一些助晶操作可控制在此介稳区域,又称育晶区; =1.2~1.3 属于中间区,不仅已有的晶体长大,同时也能有新的晶核 形成。刺激起晶常控制在此范围,同时在该区域也常产生伪晶。 >1.3 能自然起晶,晶核大量产生 ②当 =1,表示溶液为饱和溶液; ③当 <1,表示溶液为不饱和溶液,此时称为溶晶区,糖液不饱和,晶体 只能溶解,不能长大,在整理晶粒和伪晶(非起晶阶段形成的新的晶 核)时,过饱和控制在零的范围。 因此,要使结晶进行的先决条件是: >1 (四)晶核的形成 当可结晶溶质分子,在过饱和溶液中,分子的运动范围逐渐缩小,分子间的 吸引力大于排斥力,蔗糖便逐渐吸引,形成蔗糖分子的堆积点,缓缓形成晶核的 质点,并通过固晶使它继续长大,其大小达到具有晶体特性时,便称为晶核,它 在介稳区具有单独存在和继续长大的能力,这个晶核形成过程叫简称成核,也叫 起晶。 1、成核过程:在不含晶体的溶液中,由于溶质分子的热运动,即存在聚集 的可能,也存在着分散的可能,提高溶液的过饱和度或施予外界的作用,都能促 进溶质分子的聚集。晶核的形成是分子作有秩序地组合,按下列方式不断增长

食品技术原理课程讲稿-第九章食品分离加工 第 8 页 ,共 48 页 A+ A A2 A2 + A A3 . An−1 + A An 设 A 为可结晶分子,A2、A3.An-1、An 为可结晶分子的组合体。分子个数不 断进行可逆性的组合,直至达到分子结合成平衡的饱和状态为止,即: nA = An 2、溶液生成晶核质点的临界浓度:根据质量作用定律,在平衡状态时,平 衡常数为: n crit c c K = 或 n ccrit = Kc 式中: crit c - 溶液生成晶核质点的临界浓度 c - 溶液相浓度。通常用 s c c 来表示即过饱和系数 (c 为过饱和 浓度,cs 为同温度下饱和浓度) n - 分子数 K -平衡常数 平衡常数用当量平衡常数自由能表示,即: exp( ) RT E K s = − 式中 Es - 当量自由能 R - 气体常数 T - 热力学温度 生成晶核质点所包括的自由能,必须被看成属于结晶相的标准自由能。在此 情况下,它只能是晶核质点的表面自由能,其值等于晶核质点的表面积 S 与它的 表面张力 的乘积。 所以,临界浓度方程式可写成: ( ) exp( ) ( ) exp( ) RT s c c RT E c c c n s n s s crit = − = − 晶核生成速度 v 决定于临界浓度 crit c 和溶液达到临界浓度时单位时间内晶 核质点发生的概率 g ,即 ( ) exp( ) RT E c c v gc g n s s = ctit = • − g 值一般与母液的粘度 成反比,即 g 1 ,粘度愈大,晶核生成速度愈小
食品技术原理课程讲稿-第九章食品分离加工 第 8 页 ,共 48 页 A+ A A2 A2 + A A3 . An−1 + A An 设 A 为可结晶分子,A2、A3.An-1、An 为可结晶分子的组合体。分子个数不 断进行可逆性的组合,直至达到分子结合成平衡的饱和状态为止,即: nA = An 2、溶液生成晶核质点的临界浓度:根据质量作用定律,在平衡状态时,平 衡常数为: n crit c c K = 或 n ccrit = Kc 式中: crit c - 溶液生成晶核质点的临界浓度 c - 溶液相浓度。通常用 s c c 来表示即过饱和系数 (c 为过饱和 浓度,cs 为同温度下饱和浓度) n - 分子数 K -平衡常数 平衡常数用当量平衡常数自由能表示,即: exp( ) RT E K s = − 式中 Es - 当量自由能 R - 气体常数 T - 热力学温度 生成晶核质点所包括的自由能,必须被看成属于结晶相的标准自由能。在此 情况下,它只能是晶核质点的表面自由能,其值等于晶核质点的表面积 S 与它的 表面张力 的乘积。 所以,临界浓度方程式可写成: ( ) exp( ) ( ) exp( ) RT s c c RT E c c c n s n s s crit = − = − 晶核生成速度 v 决定于临界浓度 crit c 和溶液达到临界浓度时单位时间内晶 核质点发生的概率 g ,即 ( ) exp( ) RT E c c v gc g n s s = ctit = • − g 值一般与母液的粘度 成反比,即 g 1 ,粘度愈大,晶核生成速度愈小
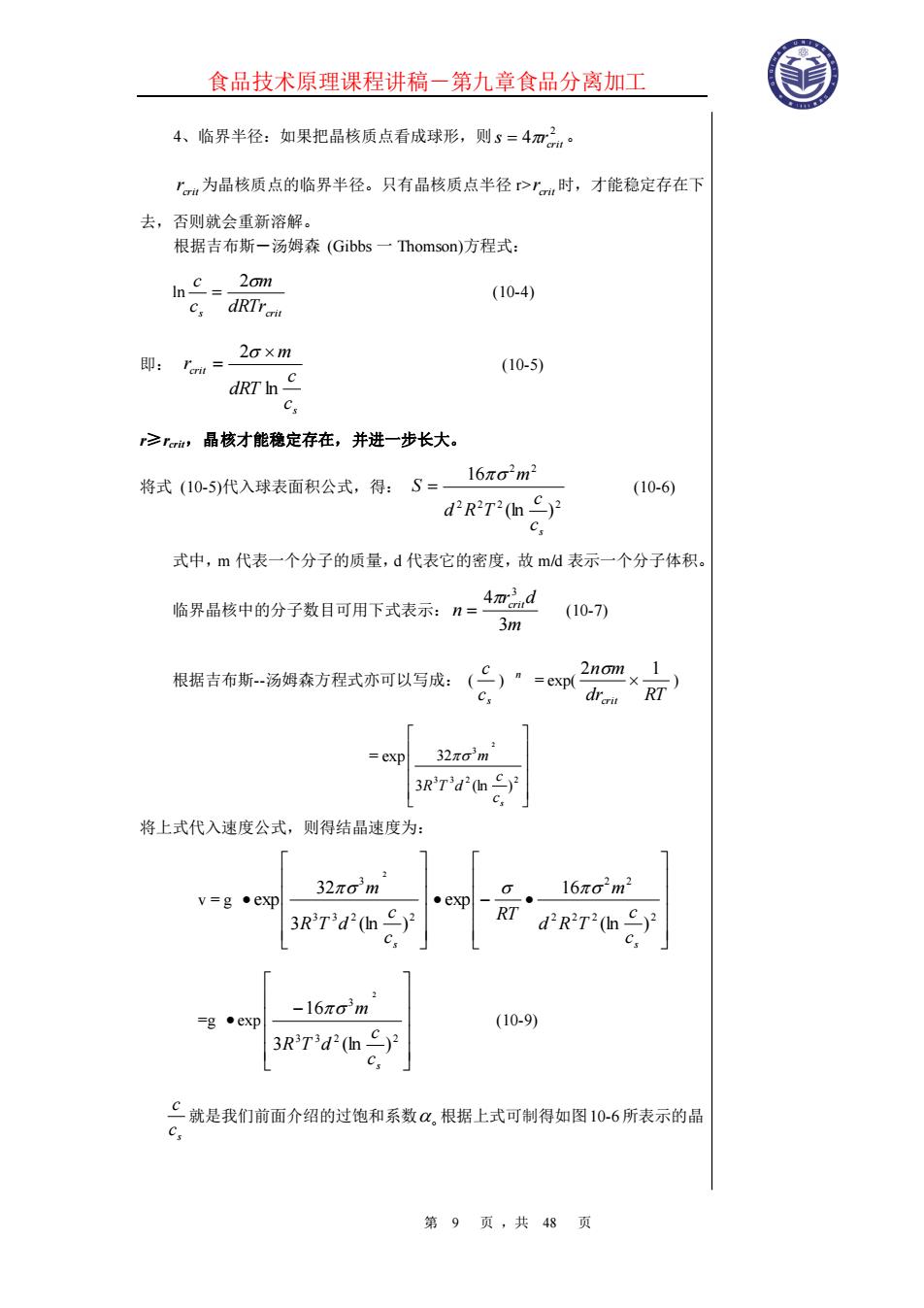
食品技术原理课程讲稿-第九章食品分离加工 第 9 页 ,共 48 页 4、临界半径:如果把晶核质点看成球形,则 2 4 crit s = r 。 crit r 为晶核质点的临界半径。只有晶核质点半径 r> crit r 时,才能稳定存在下 去,否则就会重新溶解。 根据吉布斯―汤姆森 (Gibbs 一 Thomson)方程式: ln s dRTrcrit m c c 2 = (10-4) 即: s crit c c dRT m r ln 2 = (10-5) r≥rcrit,晶核才能稳定存在,并进一步长大。 将式 (10-5)代入球表面积公式,得: 2 2 2 2 2 2 (ln ) 16 s c c d R T m S = (10-6) 式中,m 代表一个分子的质量,d 代表它的密度,故 m/d 表示一个分子体积。 临界晶核中的分子数目可用下式表示: m r d n crit 3 4 3 = (10-7) 根据吉布斯-汤姆森方程式亦可以写成: ( s c c ) n = exp( dr RT n m crit 2 1 ) = exp 3 3 2 2 3 3 (ln ) 32 2 s c c R T d m 将上式代入速度公式,则得结晶速度为: v = g • 3 3 2 2 3 3 (ln ) 32 exp 2 s c c R T d m • − • 2 2 2 2 2 2 (ln ) 16 exp s c c d R T m RT =g • exp − 3 3 2 2 3 3 (ln ) 16 2 s c c R T d m (10-9) s c c 就是我们前面介绍的过饱和系数 根据上式可制得如图10-6所表示的晶
食品技术原理课程讲稿-第九章食品分离加工 第 9 页 ,共 48 页 4、临界半径:如果把晶核质点看成球形,则 2 4 crit s = r 。 crit r 为晶核质点的临界半径。只有晶核质点半径 r> crit r 时,才能稳定存在下 去,否则就会重新溶解。 根据吉布斯―汤姆森 (Gibbs 一 Thomson)方程式: ln s dRTrcrit m c c 2 = (10-4) 即: s crit c c dRT m r ln 2 = (10-5) r≥rcrit,晶核才能稳定存在,并进一步长大。 将式 (10-5)代入球表面积公式,得: 2 2 2 2 2 2 (ln ) 16 s c c d R T m S = (10-6) 式中,m 代表一个分子的质量,d 代表它的密度,故 m/d 表示一个分子体积。 临界晶核中的分子数目可用下式表示: m r d n crit 3 4 3 = (10-7) 根据吉布斯-汤姆森方程式亦可以写成: ( s c c ) n = exp( dr RT n m crit 2 1 ) = exp 3 3 2 2 3 3 (ln ) 32 2 s c c R T d m 将上式代入速度公式,则得结晶速度为: v = g • 3 3 2 2 3 3 (ln ) 32 exp 2 s c c R T d m • − • 2 2 2 2 2 2 (ln ) 16 exp s c c d R T m RT =g • exp − 3 3 2 2 3 3 (ln ) 16 2 s c c R T d m (10-9) s c c 就是我们前面介绍的过饱和系数 根据上式可制得如图10-6所表示的晶

食品技术原理课程讲稿-第九章食品分离加工 第 10 页 ,共 48 页 核形成速度与过饱和系数的关系。即随着溶液过饱和系数逐渐增大,晶核临界半 径随之变小(由临界半径表达式可知),形成稳定晶核的机会逐渐增加,及至溶液 浓度到达某一过饱和度,晶核便会自发形成,并随过饱和系数的进一步增大,成 核速度将逐渐加快。 由量变引起相变而析出晶核质点的推动力是过饱和浓度与平衡溶解度(即饱 和浓度)之差(△c),后者随着温度而变化。为了达到起晶的目的,一般采用 3 种 方法来调节过饱和浓度和平衡溶解度:①蒸发浓缩;②绝热蒸发(闪蒸);③冷却。 各种方法与浓缩溶液的关系如图 10-7 所示。 由图 10-7 可以找出溶液起晶最大浓度差与温度关系,如下: △c最大 =( dt dc )△ t最大 (10-10) 式中 dt dc 一一平衡溶解度曲线的斜率 t最大 一一达到过饱和度的温差最大值 c最大 一一达到过饱和度的浓度差最大值 由图 10-7 可以找出溶液起晶最大浓度差与温度关系,如下: △c最大 =( dt dc )△ t最大 (10-10) 式中: dt dc 一一平衡溶解度曲线的斜率 t最大 一一达到过饱和度的温差最大值 c最大 一一达到过饱和度的浓度差最大 5、成核速度与影响成核的因素 根据阿伦尼乌斯方程式,成核速度为: G RT N Ae− max / = 其中 = 2 3 2 max 16 / 3 ln s c c G m RTd 式中 N - 成核速度。即单位体积溶液,在单位时间内晶核数目的增多 A - 系数 对于饱和溶液, = 1 s c c , ln = 0 s c c ,成核需要的能量为无穷大,成核速度 为零。所以饱和溶液中,不能自动成核。 下面对影响成核速度的因素进行讨论。 (1)溶液过饱和度的影响:在一定的温度下 = 2 3 2 max 16 / 3 ln s c c G m RTd 可用图 10-9 中的实线表示。图中的实线
食品技术原理课程讲稿-第九章食品分离加工 第 10 页 ,共 48 页 核形成速度与过饱和系数的关系。即随着溶液过饱和系数逐渐增大,晶核临界半 径随之变小(由临界半径表达式可知),形成稳定晶核的机会逐渐增加,及至溶液 浓度到达某一过饱和度,晶核便会自发形成,并随过饱和系数的进一步增大,成 核速度将逐渐加快。 由量变引起相变而析出晶核质点的推动力是过饱和浓度与平衡溶解度(即饱 和浓度)之差(△c),后者随着温度而变化。为了达到起晶的目的,一般采用 3 种 方法来调节过饱和浓度和平衡溶解度:①蒸发浓缩;②绝热蒸发(闪蒸);③冷却。 各种方法与浓缩溶液的关系如图 10-7 所示。 由图 10-7 可以找出溶液起晶最大浓度差与温度关系,如下: △c最大 =( dt dc )△ t最大 (10-10) 式中 dt dc 一一平衡溶解度曲线的斜率 t最大 一一达到过饱和度的温差最大值 c最大 一一达到过饱和度的浓度差最大值 由图 10-7 可以找出溶液起晶最大浓度差与温度关系,如下: △c最大 =( dt dc )△ t最大 (10-10) 式中: dt dc 一一平衡溶解度曲线的斜率 t最大 一一达到过饱和度的温差最大值 c最大 一一达到过饱和度的浓度差最大 5、成核速度与影响成核的因素 根据阿伦尼乌斯方程式,成核速度为: G RT N Ae− max / = 其中 = 2 3 2 max 16 / 3 ln s c c G m RTd 式中 N - 成核速度。即单位体积溶液,在单位时间内晶核数目的增多 A - 系数 对于饱和溶液, = 1 s c c , ln = 0 s c c ,成核需要的能量为无穷大,成核速度 为零。所以饱和溶液中,不能自动成核。 下面对影响成核速度的因素进行讨论。 (1)溶液过饱和度的影响:在一定的温度下 = 2 3 2 max 16 / 3 ln s c c G m RTd 可用图 10-9 中的实线表示。图中的实线