
实验一实验动物给药途径和方法 一、动物的编号、捉套和固定。 1、动物的编号犬、兔等动物可用特制的号码牌固定于耳。白色家兔和小动物可用35% 的黄色苦味酸溶液涂于毛上标号。如编号110号时,将小白鼠背部分前肢、腰部、后 肢的左、中、右部共九个区域,从右到左1-9号,第10号不涂黄色(图1-1)如加上其它颜色 的染料还可进行1-100号和1-1000号等更多编号。 图1-1小白鼠背部编号 图1-2小白鼠双手捉持法 (引自:医学技能学实验教程.白波2004) (引自:医学技能学实验教程.白波2004) 2、动物的捉拿和固定 ①小鼠:右手抓住其尾,放在实验台上或鼠笼铁纱网上,在其向前爬时,左手拇指及食 指沿其背抓住两耳及头颈部皮肤,并以左手的小指和掌部夹住鼠尾固定。另 抓法是只用手 用食指和拇指抓住鼠尾后再用小指和掌部夹住鼠尾,以拇指及食指捏住其颈部皮肤。前一种 方法易学,后一种方法便于快速捉拿。(见图1-2,1-3) 图13小白鼠双手捉持法 (引自:医学技能学实验教程白波2004) ②大鼠:以右手或持夹子夹住尾巴,左手戴上防护手套固定头部防止被咬,应避免用力 过大造成大鼠室总死亡。根据实验需要麻醉或固定大鼠于鼠笼内或用绳绑其四肢固定于大鼠 手术板上。 ③豚鼠:以右手抓住豚鼠头颈部,将其两前肢在豚鼠头与右手拇指与食指之间,轻轻扣 住颈胸部,右手抓住两后肢(对体重较大的豚鼠则可托起其臀部),使腹部向上 ④兔:用手抓起兔脊背近后颈部皮肤,手抓面积应尽量大些。以另一手托起兔的臀部, 将兔仰卧固定时,一手抓住颈部皮肤,另一只手顺着腹部抚摸至膝关节处压住关节。另一人 将绳子用活结捆绑免的四肢,使兔腹部向上固定在兔手术台上。头部则用兔头固定夹固定, 也可用棉线将兔的门牙固定于兔手术台上的柱子上,后者更常用(图14)
实验一 实验动物给药途径和方法 一、动物的编号、捉拿和固定。 1、动物的编号 犬、兔等动物可用特制的号码牌固定于耳。白色家兔和小动物可用 3-5% 的黄色苦味酸溶液涂于毛上标号。如编号 1-10 号时,将小白鼠背部分前肢、腰部、后 肢的左、中、右部共九个区域,从右到左 1-9 号,第 10 号不涂黄色(图 1-1)如加上其它颜色 的染料还可进行 1-100 号和 1-1000 号等更多编号。 图 1-1 小白鼠背部编号 图 1-2 小白鼠双手捉持法 (引自:医学技能学实验教程. 白波. 2004) (引自:医学技能学实验教程. 白波. 2004) 2、动物的捉拿和固定 ①小鼠:右手抓住其尾,放在实验台上或鼠笼铁纱网上,在其向前爬时,左手拇指及食 指沿其背抓住两耳及头颈部皮肤,并以左手的小指和掌部夹住鼠尾固定。另一抓法是只用手, 用食指和拇指抓住鼠尾后再用小指和掌部夹住鼠尾,以拇指及食指捏住其颈部皮肤。前一种 方法易学,后一种方法便于快速捉拿。(见图 1-2,1-3) 图 1-3 小白鼠双手捉持法 (引自:医学技能学实验教程. 白波. 2004) ②大鼠:以右手或持夹子夹住尾巴,左手戴上防护手套固定头部防止被咬,应避免用力 过大造成大鼠窒息死亡。根据实验需要麻醉或固定大鼠于鼠笼内或用绳绑其四肢固定于大鼠 手术板上。 ③豚鼠:以右手抓住豚鼠头颈部,将其两前肢在豚鼠头与右手拇指与食指之间,轻轻扣 住颈胸部,右手抓住两后肢(对体重较大的豚鼠则可托起其臀部),使腹部向上。 ④兔:用手抓起兔脊背近后颈部皮肤,手抓面积应尽量大些。以另一手托起兔的臀部。 将兔仰卧固定时,一手抓住颈部皮肤,另一只手顺着腹部抚摸至膝关节处压住关节。另一人 将绳子用活结捆绑兔的四肢,使兔腹部向上固定在兔手术台上。头部则用兔头固定夹固定, 也可用棉线将兔的门牙固定于兔手术台上的柱子上,后者更常用(图 1-4)

图14家兔捉持法 (引自:医学技能学实验教程.白波2004) 二、实验动物的去毛 动物去毛是手术野的皮肤准备之一。原则是去毛范围应大于手术野,不破坏皮肤的完整 性。具体方法有: 1、剪毛法常用于兔犬去毛。操作时用剪刀紧贴皮肤依次剪毛,切忌提起皮肤,否则将剪 破皮肤。剪下的毛应放入盛有少量水的杯中,并可用湿纱布擦去已剪断的毛。 2、拨毛法:一般用于兔和犬的静脉输液部位。拨毛除使视野清晰外,还能刺激局部血管扩 3、单制手法,讲行动物的梅性实验时用。 4、脱毛法:用于动物的无菌手术,一般先将手术野的毛剪短,用脱毛液在局部涂一层注意 手不要直接接触脱毛液),待2-3mi后用清水洗去脱落的毛,再用纱布擦干后涂一层凡士林。 在此介绍两种脱毛液配方。配方1:硫化钠3,肥皂粉1,淀粉7,加水调成糊状。配方2: 8%的硫化钠水溶液。 三、实验动物的药方法 在动物实验中 为了观察药物对机能功能、代谢及形态引起的变化,常需将药物注入动 物体内。给药的途径和方法是多种多样的,可根据实验目的、实验动物种类和药物剂型等情 况确定。 (一)皮下注射 注射时以左手拇指和合指提起皮肤,将连有5(12)号针头的注射器划入皮下。皮下注 射部位一般狗、猫多在大腿外侧,豚鼠在后大腿的内侧或小腹部:大白鼠可在侧下腹部。免 在背部或耳根部注射。蛙可在脊背部淋巴腔注射。 (二)皮内注射 皮内注射时需将注射的局部脱去被毛,消毒后,用左手拇指和食指按住皮肤并使之绷紧, 在两指之间,用结核菌素注射器连4(12)细针头,紧贴皮肤表层刺入皮内,然后再向上挑起 并再稍刺入,即可注射药液,此时可见皮肤表面鼓起一白色小皮丘。 (三)肌肉注射 肌肉注射应选肌肉发达,无大血管通过的部位,一般多选臀部。注射时垂直迅速刺入肌 肉,回抽针栓如无回血,即可进行注射。给小白鼠、大白鼠等小动物作肌肉注射时,用左手 抓住鼠两耳和头部皮肤,右手取连有5(12)针头的注射器,将针头刺入大腿外侧肌肉,将 药液注入 (四)腹腔注射 用大、小白鼠做实验时,以左手抓住动物,使腹部向上,右手将注射针头于左(或右) 下腹部刺入皮下,使针头向前推0.51.0cm,再以45度角穿过腹肌,固定针头,缓缓注入 药液(图1-5),为避免伤及内脏,可使动物处于头低位,使内脏移向上腹。若实验动物为
图 1-4 家兔捉持法 (引自:医学技能学实验教程. 白波. 2004) 二、实验动物的去毛 动物去毛是手术野的皮肤准备之一。原则是去毛范围应大于手术野,不破坏皮肤的完整 性。具体方法有: 1、剪毛法 常用于兔犬去毛。操作时用剪刀紧贴皮肤依次剪毛,切忌提起皮肤,否则将剪 破皮肤。剪下的毛应放入盛有少量水的杯中,并可用湿纱布擦去已剪断的毛。 2、拨毛法:一般用于兔和犬的静脉输液部位。拨毛除使视野清晰外,还能刺激局部血管扩 张。 3、剃毛法:进行动物的慢性实验时用。 4、脱毛法:用于动物的无菌手术,一般先将手术野的毛剪短,用脱毛液在局部涂一层(注意 手不要直接接触脱毛液),待 2-3min 后用清水洗去脱落的毛,再用纱布擦干后涂一层凡士林。 在此介绍两种脱毛液配方。配方 1:硫化钠 3,肥皂粉 1,淀粉 7,加水调成糊状。配方 2: 8%的硫化钠水溶液。 三、实验动物的药方法 在动物实验中,为了观察药物对机能功能、代谢及形态引起的变化,常需将药物注入动 物体内。给药的途径和方法是多种多样的,可根据实验目的、实验动物种类和药物剂型等情 况确定。 (一)皮下注射 注射时以左手拇指和食指提起皮肤,将连有 5(1/2)号针头的注射器刺入皮下。皮下注 射部位一般狗、猫多在大腿外侧,豚鼠在后大腿的内侧或小腹部;大白鼠可在侧下腹部。兔 在背部或耳根部注射。蛙可在脊背部淋巴腔注射。 (二)皮内注射 皮内注射时需将注射的局部脱去被毛,消毒后,用左手拇指和食指按住皮肤并使之绷紧, 在两指之间,用结核菌素注射器连 4(1/2)细针头,紧贴皮肤表层刺入皮内,然后再向上挑起 并再稍刺入,即可注射药液,此时可见皮肤表面鼓起一白色小皮丘。 (三)肌肉注射 肌肉注射应选肌肉发达,无大血管通过的部位,一般多选臀部。注射时垂直迅速刺入肌 肉,回抽针栓如无回血,即可进行注射。给小白鼠、大白鼠等小动物作肌肉注射时,用左手 抓住鼠两耳和头部皮肤,右手取连有 5(1/2)针头的注射器,将针头刺入大腿外侧肌肉,将 药液注入。 (四)腹腔注射 用大、小白鼠做实验时,以左手抓住动物,使腹部向上,右手将注射针头于左(或右) 下腹部刺入皮下,使针头向前推 0.5-1.0cm,再以 45 度角穿过腹肌,固定针头,缓缓注入 药液(图 1-5),为避免伤及内脏,可使动物处于头低位,使内脏移向上腹。若实验动物为

家兔,进针部位为下腹部的腹白线离开lcm处。 图15小白鼠腹腔注射方法 图1-6家兔耳缘静脉注射方法 (五)静脉注射 1、兔:兔耳部血管分布清晰。兔耳中央为动物,耳外缘为静脉。内缘静脉深不易固定 故不用。外缘静脉表浅易固定,常用。先拔去注射部位的被毛,用手指弹动或轻揉兔耳,使 静脉充盈,左手食指和中指夹住静脉的近端,拇指紧静脉的远端,无名指及小指垫在下面 右手持注射器连6号针头尽量从静脉的远端刺入,移动拇指于针头上以固定针头,放开食指 和中指,将药液注入(图1-6),然后拔出针头,用手压迫针眼片刻。 2、小白鼠和大白鼠: 一般采用星静注射。鼠民静脉右二相左右两侧及背侧一根 左右两侧尾静脉比较容易周定,多采用, 背侧一根也可采用,但位置容易 定。操作时先将 动物固定在鼠筒内或扣在烧杯中,使尾巴露出,尾部用45-50C的温水浸润半分钟或用酒精 擦拭使血管扩张,并可使表皮角质软化,以左手拇指和食指捏住鼠尾两侧,使静脉充盈,用 中指从下面托起尾巴,以无名指和小指夹住尾巴的末梢,右手持注射器连412)号细针头, 使针头与静脉平行(小30℃),从尾下四分之一处(约距昆尖2.3m)处讲针,此外皮 易于刺入,先缓注少量药液,如无阻力,表示针头已进入静脉,可继续注入。注射完毕后托 尾部向注射侧弯曲以止血。如需反复注射,应尽可能从末端开始,以后向尾根部方向移动注 射(图1-7)。 e-.-85n- 3m2 英 图1-7小鼠尾静脉注射方法 3、狗.狗静脉注射多洗前肢内侧皮下美静脉(图1-8)或后肢小隐静脉(图19)注 射。注射前由助手将动物侧卧,剪去注 部位的被毛,用胶皮带扎紧(或用手抓紧)静脉远 端,使血管充盈,从静脉的远端将注射针头平行刺入血管,待有回血后,松开绑带(或两手), 缓缓注入药
家兔,进针部位为下腹部的腹白线离开 1cm 处。 图 1-5 小白鼠腹腔注射方法 图 1-6 家兔耳缘静脉注射方法 (五)静脉注射 1、兔:兔耳部血管分布清晰。兔耳中央为动物,耳外缘为静脉。内缘静脉深不易固定, 故不用。外缘静脉表浅易固定,常用。先拔去注射部位的被毛,用手指弹动或轻揉兔耳,使 静脉充盈,左手食指和中指夹住静脉的近端,拇指绷紧静脉的远端,无名指及小指垫在下面, 右手持注射器连 6 号针头尽量从静脉的远端刺入,移动拇指于针头上以固定针头,放开食指 和中指,将药液注入(图 1-6),然后拔出针头,用手压迫针眼片刻。 2、小白鼠和大白鼠:一般采用尾静脉注射,鼠尾静脉有三根,左右两侧及背侧各一根, 左右两侧尾静脉比较容易固定,多采用,背侧一根也可采用,但位置容易固定。操作时先将 动物固定在鼠筒内或扣在烧杯中,使尾巴露出,尾部用 45-50℃的温水浸润半分钟或用酒精 擦拭使血管扩张,并可使表皮角质软化,以左手拇指和食指捏住鼠尾两侧,使静脉充盈,用 中指从下面托起尾巴,以无名指和小指夹住尾巴的末梢,右手持注射器连 4(1/2)号细针头, 使针头与静脉平行(小于 30℃),从尾下四分之一处(约距尾尖 2-3cm)处进针,此处皮薄 易于刺入,先缓注少量药液,如无阻力,表示针头已进入静脉,可继续注入。注射完毕后把 尾部向注射侧弯曲以止血。如需反复注射,应尽可能从末端开始,以后向尾根部方向移动注 射(图 1-7)。 图 1-7 小鼠尾静脉注射方法 3、狗:狗静脉注射多选前肢内侧皮下头静脉(图 1-8)或后肢小隐静脉(图 1-9)注 射。注射前由助手将动物侧卧,剪去注射部位的被毛,用胶皮带扎紧(或用手抓紧)静脉近 端,使血管充盈,从静脉的远端将注射针头平行刺入血管,待有回血后,松开绑带(或两手), 缓缓注入药

图8狗曾防头静脉注时 图19狗后肢小隐静脉注射 4、蛙(或蟾蜍):将蛙或蟾蜍脑脊髓破坏后,仰卧固定于蛙板上,沿腹中线稍左剪开腹 肌,可见到腹静脉贴腹壁肌肉下行,将注射针头沿血管平行方向刺入即可(图11O。 (六)淋巴囊注射 蛙类常采用此法,因其皮下有数个淋巴囊,注入药物甚易吸收。腹部淋巴囊和头背淋巴 囊常作为蛙类给药途径。一般多选用腹部淋巴囊给药。注射时将针头从蛙大腿上端刺入,经 大腿肌层入腹壁肌层,再进入腹壁皮下,即进入淋巴囊,然后注入药液。有时也可采用胸淋 巴囊给药,方法是将针头刺入口腔,使穿过下颌肌层入胸淋巴囊内注入药液】 一次是大注舟 量为1毫升。蛙全身分布为咽、胸、背、腹侧、腹、大腿和脚等七个淋巴囊(图11)。 0 图1-10蛙腹壁静静注射 几种常用的动物不同给药途径的注射量可参考表1~1。 表1-1几种动物不同给药途径的常用注射量(ml) 注射途径 小鼠 大鼠 豚鼠 兔 腹腔 0.2-1.0 1-3 2-5 5-10 5-15 肌 肉 0.1-0.2 0.2-0.5 0.2-0.5 0.5-1.0 2-5 静 0.2-0.5 1-2 1-5 3-10 5-15 0.1-0.5 0.5-1.0 0.5-2 1.0-3.0 3-10
图 1-8 狗前肢头静脉注射 图 1-9 狗后肢小隐静脉注射 4、蛙(或蟾蜍):将蛙或蟾蜍脑脊髓破坏后,仰卧固定于蛙板上,沿腹中线稍左剪开腹 肌,可见到腹静脉贴着腹壁肌肉下行,将注射针头沿血管平行方向刺入即可(图 1-10)。 (六)淋巴囊注射 蛙类常采用此法,因其皮下有数个淋巴囊,注入药物甚易吸收。腹部淋巴囊和头背淋巴 囊常作为蛙类给药途径。一般多选用腹部淋巴囊给药。注射时将针头从蛙大腿上端刺入,经 大腿肌层入腹壁肌层,再进入腹壁皮下,即进入淋巴囊,然后注入药液。有时也可采用胸淋 巴囊给药。方法是将针头刺入口腔,使穿过下颌肌层入胸淋巴囊内注入药液,一次最大注射 量为 1 毫升。蛙全身分布为咽、胸、背、腹侧、腹、大腿和脚等七个淋巴囊(图 1-11)。 图 1-10 蛙腹壁静静注射 几种常用的动物不同给药途径的注射量可参考表 1-1。 表 1-1 几种动物不同给药途径的常用注射量(ml) 注射途径 小鼠 大鼠 豚鼠 兔 狗 腹 腔 0.2-1.0 1-3 2-5 5-10 5-15 肌 肉 0.1-0.2 0.2-0.5 0.2-0.5 0.5-1.0 2-5 静 脉 0.2-0.5 1-2 1-5 3-10 5-15 皮 下 0.1-0.5 0.5-1.0 0.5-2 1.0-3.0 3-10
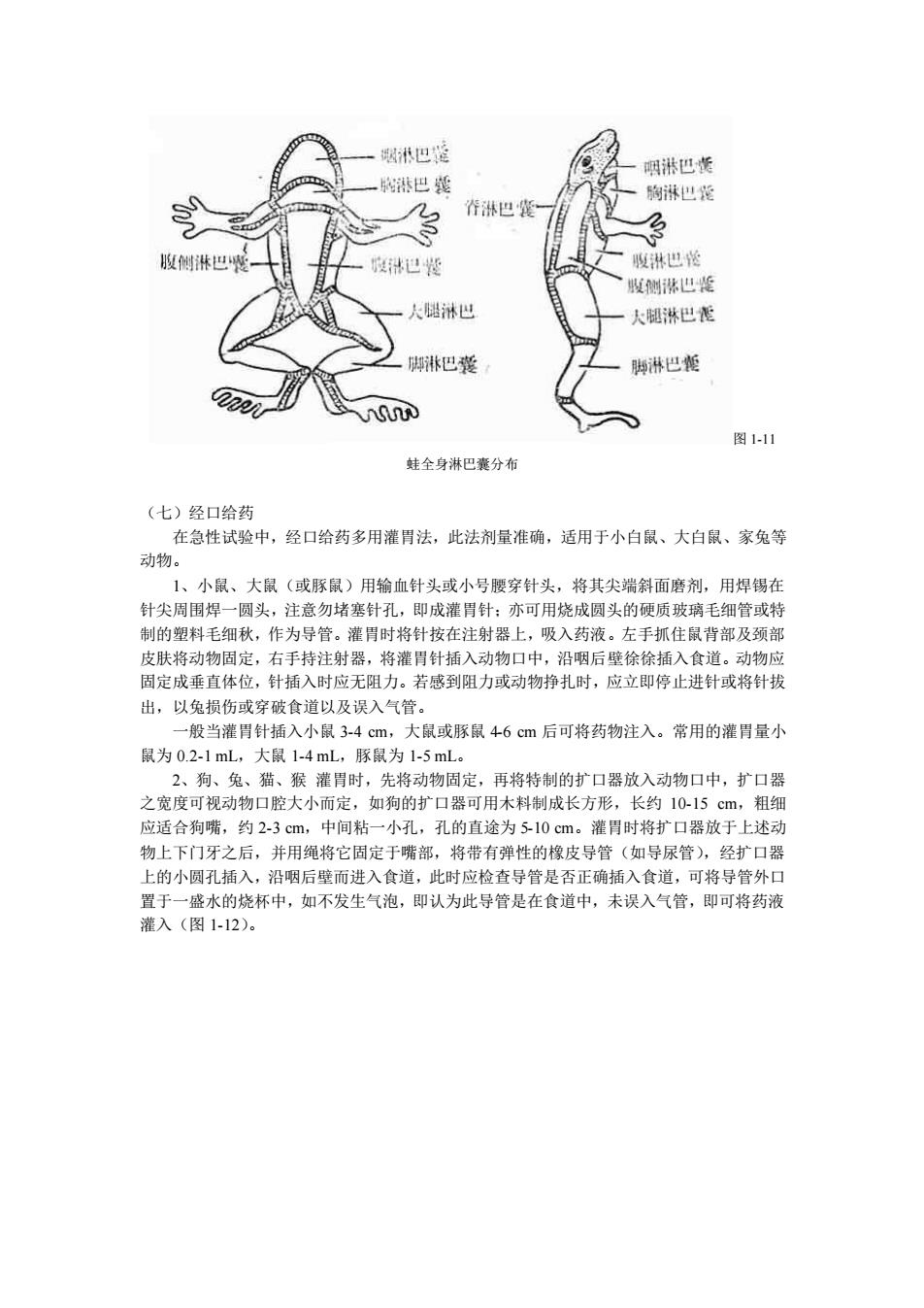
港巴 侧淋巴 大腿淋巴震 脚淋巴囊 脚淋巴瘦 蛙全身淋巴囊分布 (七)经口给药 在急性试验中,经口给药多用灌胃法,此法剂量准确,适用于小白鼠、大白鼠、家兔等 动物 1、小鼠、大鼠(或豚鼠)用输血针头或小号腰穿针头,将其尖端斜面磨剂,用焊锡在 针尖周围焊一圆头,注意勿堵塞针孔,即成灌胃针:亦可用烧成圆头的硬质玻璃毛细管或特 制的塑料毛细秋,作为导管。灌胃时将针按在注射器上,吸入药液。左手抓住鼠背部及颈部 专肤将动物固定,右毛持注射器,将灌胃针插入动物口中,沿后壁徐徐插入食消。动物耐 固定成垂直体位,针插入时应无阻力。若感到阻力或动物挣扎时,应立即停止进针或将针拔 出,以兔损伤或穿破食道以及误入气管。 一般当灌胃针插入小鼠34cm,大鼠或豚鼠46cm后可将药物注入。常用的灌胃量小 鼠为0.2-1mL,大鼠1-4mL,豚鼠为1-5mL。 2、狗、兔、猎、猴灌胃时,先将动物周定,再将特制的扩口器放入动物口中,扩口翠 之宽度可视动物口腔大小而定,如狗的扩口器可用木料制成长方形,长约1015 1粗细 应适合嘴,约2一3m中间粘一小孔。孔的直途为510m。灌胃时将扩口器放于上述动 物上下门牙之后,并用绳将它固定于嘴部,将带有弹性的橡皮导管(如导尿管),经扩口器 上的小圆孔插入,沿咽后壁而进入食道,此时应检查导管是否正确插入食道,可将导管外口 置于一盛水的烧杯中,如不发生气泡,即认为此导管是在食道中,未误入气管,即可将药液 灌入(图1-12)
图 1-11 蛙全身淋巴囊分布 (七)经口给药 在急性试验中,经口给药多用灌胃法,此法剂量准确,适用于小白鼠、大白鼠、家兔等 动物。 1、小鼠、大鼠(或豚鼠)用输血针头或小号腰穿针头,将其尖端斜面磨剂,用焊锡在 针尖周围焊一圆头,注意勿堵塞针孔,即成灌胃针;亦可用烧成圆头的硬质玻璃毛细管或特 制的塑料毛细秋,作为导管。灌胃时将针按在注射器上,吸入药液。左手抓住鼠背部及颈部 皮肤将动物固定,右手持注射器,将灌胃针插入动物口中,沿咽后壁徐徐插入食道。动物应 固定成垂直体位,针插入时应无阻力。若感到阻力或动物挣扎时,应立即停止进针或将针拔 出,以兔损伤或穿破食道以及误入气管。 一般当灌胃针插入小鼠 3-4 cm,大鼠或豚鼠 4-6 cm 后可将药物注入。常用的灌胃量小 鼠为 0.2-1 mL,大鼠 1-4 mL,豚鼠为 1-5 mL。 2、狗、兔、猫、猴 灌胃时,先将动物固定,再将特制的扩口器放入动物口中,扩口器 之宽度可视动物口腔大小而定,如狗的扩口器可用木料制成长方形,长约 10-15 cm,粗细 应适合狗嘴,约 2-3 cm,中间粘一小孔,孔的直途为 5-10 cm。灌胃时将扩口器放于上述动 物上下门牙之后,并用绳将它固定于嘴部,将带有弹性的橡皮导管(如导尿管),经扩口器 上的小圆孔插入,沿咽后壁而进入食道,此时应检查导管是否正确插入食道,可将导管外口 置于一盛水的烧杯中,如不发生气泡,即认为此导管是在食道中,未误入气管,即可将药液 灌入(图 1-12)