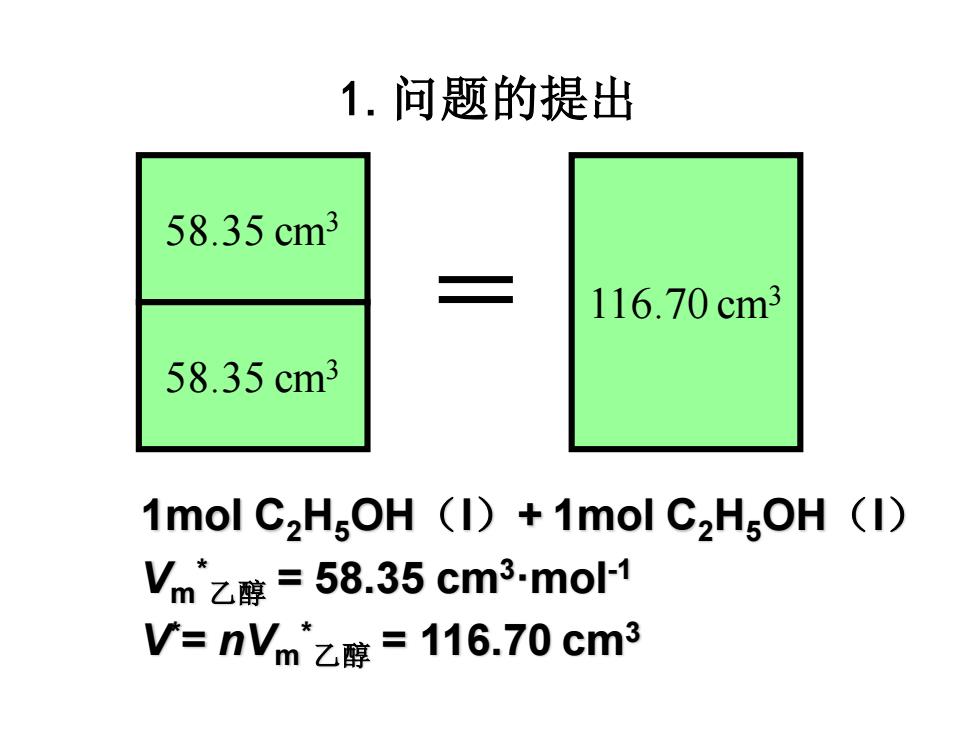
1.问题的提出 58.35cm3 116.70cm3 58.35cm3 1mol C2HgOH (I)+1mol C,HgOH (I) Vm乙醇=58.35cm3-mo1 V=nVm乙醇=116.70cm3
1.问题的提出 1mol C2H5OH(l)+ 1mol C2H5OH(l) Vm * 乙醇 = 58.35 cm3·mol-1 V* = nVm * 乙醇 = 116.70 cm3 58.35 cm3 58.35 cm3 = 116.70 cm3
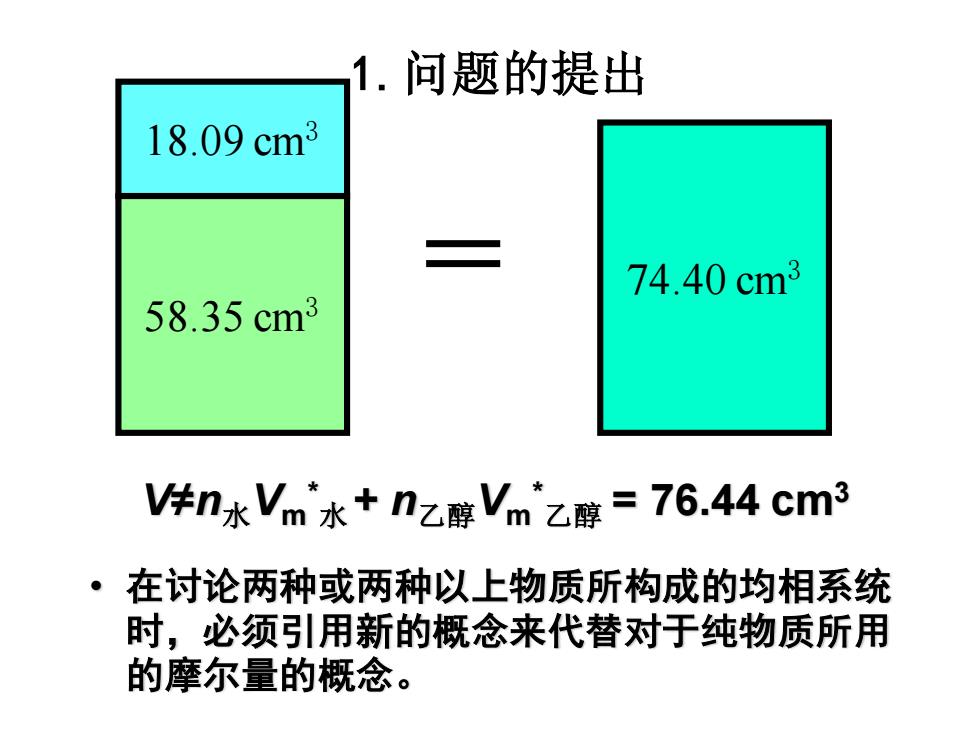
1.问题的提出 18.09cm3 74.40cm3 58.35cm3 V件n水Vm水+nz醇Vm乙醇=76.44cm3 在讨论两种或两种以上物质所构成的均相系统 时,必须引用新的概念来代替对于纯物质所用 的摩尔量的概念
1.问题的提出 58.35 cm3 18.09 cm3 = 74.40 cm3 V≠n水Vm * 水 + n乙醇Vm * 乙醇 = 76.44 cm3 • 在讨论两种或两种以上物质所构成的均相系统 时,必须引用新的概念来代替对于纯物质所用 的摩尔量的概念

§4.3偏摩尔量 多组分系统与单组分系统的差别 单组分系统的广度性质具有加和性 若1mol单组分B物质的体积为 则2ol单组分B物质的体积为 而1mol单组分B物质和1mol单组分C物质混合, 得到的混合体积可能有两种情况: ()V=1 molxImB+1mol×c 形成了混合物 (2)V≠1mol×B+1mol×Vc 形成了溶液
§4.3 偏摩尔量 单组分系统的广度性质具有加和性 * 若 Vm,B 1 mol单组分B物质的体积为 * 则2 mol单组分B物质的体积为 2 Vm,B 而1 mol单组分B物质和1 mol单组分C物质混合, 得到的混合体积可能有两种情况: * * m,B m,C (1) 1 mol 1 mol V V V = + * * m,B m,C (2) 1 mol 1 mol V + V V 形成了混合物 形成了溶液 多组分系统与单组分系统的差别

1.偏摩尔量的定义 在多组分系统中,每个热力学函数的变量就 不止两个,还与组成系统各物的物质的量有关 设系统中有1,2,3,.,k个组分 系统中任一容量性质Z(代表V,U,H, S,A,G等)除了与温度、压力有关外,还与 各组分的数量有关,即 Z=Z(T,p,n,n2.,n) 如果温度、压力和组成有微小的变化,则 系统中任一容量性质Z的变化为:
1. 偏摩尔量的定义 在多组分系统中,每个热力学函数的变量就 不止两个,还与组成系统各物的物质的量有关 1 2 k Z Z T p n n n = ( , , , , , ) 系统中任一容量性质Z(代表V,U,H, S,A,G等)除了与温度、压力有关外,还与 各组分的数量有关,即 设系统中有 1,2,3, ,k 个组分 如果温度、压力和组成有微小的变化,则 系统中任一容量性质Z的变化为:
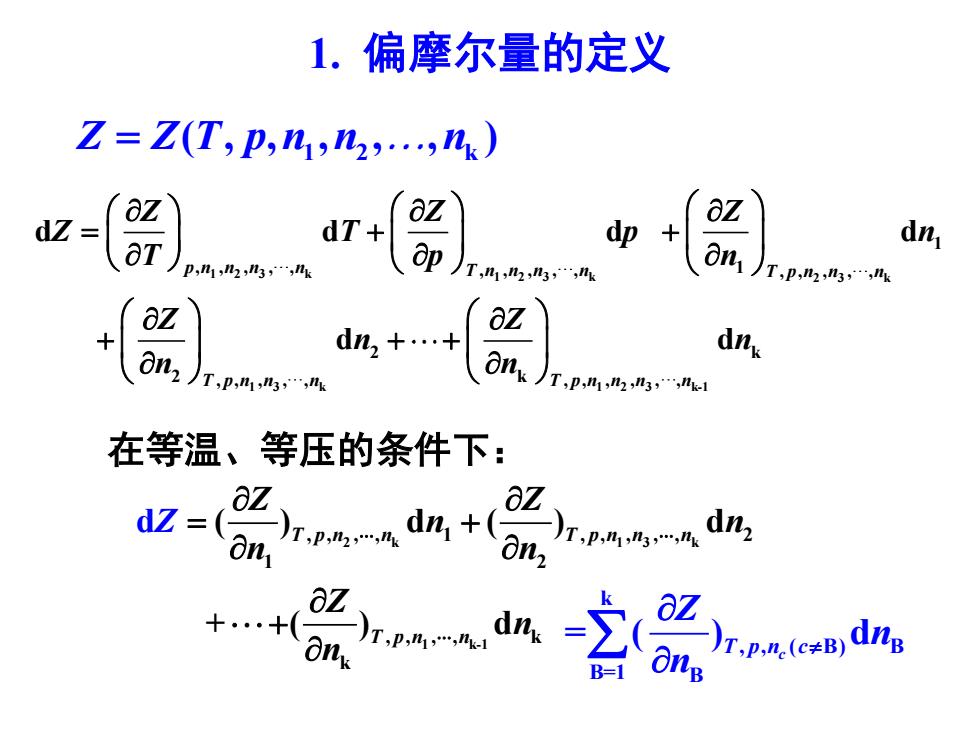
1.偏摩尔量的定义 Z=Z(T,p,n,n2.,nk) aZ dZ=OT) dT+ aZ d即+ aZ dn ,123k 0)T,西 T,p,2,n aZ dn2++ az dnx T,p,1,3, nT,pmm西,1 在等温、等压的条件下: ☑=xpa.dn+Lna
1. 偏摩尔量的定义 1 2 3 k 1 2 3 k 2 3 k 1 3 k 1 2 3 k-1 1 , , , , , , , , , , 1 , , , , , 2 k 2 k , , , , , , , , , , , d d d d d d p n n n n T n n n n T p n n n T p n n n T p n n n n Z Z Z Z T p n T p n Z Z n n n n = + + + + + 在等温、等压的条件下: 2 k 1 3 k 1 k-1 , , , , 1 , , , , , 2 1 2 , , , , k k d ( ) d ( ) d + ( ) d T p n n T p n n n T p n n Z Z n n n n Z n n Z = + + k , , ( B) B B=1 B = ( ) d T p n c c Z n n 1 2 k Z Z T p n n n = ( , , , , , )