
§4.2 多组分系统的组成表示法 4.B的摩尔分数 XB def XB n 即指B的物质的量与混合物总的物质的量之比 称为B的摩尔分数,又称为物质的量分数。 摩尔分数的单位为1 气态混合物中摩尔分数常用yB表示 P206例1
§4.2 多组分系统的组成表示法 B B A A def n x n 即指B的物质的量与混合物总的物质的量之比 称为B的摩尔分数,又称为物质的量分数。 摩尔分数的单位为1 4. B的摩尔分数 B x 气态混合物中摩尔分数常用 yB 表示 P206 例1

在溶液中,表示溶质浓度的方法有: (1)溶质B的质量摩尔浓度B def m(A) 溶质B的物质的量与溶剂A的质量之比称为 溶质B的质量摩尔浓度。 质量摩尔浓度的单位是mol·kg 这个表示方法的优点是可以用准确的称重法 来配制溶液,不受温度影响,电化学中用的很多
(1)溶质B的质量摩尔浓度mB B B def (A) n m m 溶质B的物质的量与溶剂A的质量之比称为 溶质B的质量摩尔浓度。 这个表示方法的优点是可以用准确的称重法 来配制溶液,不受温度影响,电化学中用的很多 在溶液中,表示溶质浓度的方法有: 质量摩尔浓度的单位是 1 mol kg− m b B B =

在溶液中,表示溶质浓度的方法有: (2)溶质B的摩尔比TB def ne 溶质B的物质的量与溶剂A的物质的量之比 溶质B的摩尔比的单位是1 P206例2
(2)溶质B的摩尔比 rB B B A def n r n 溶质B的物质的量与溶剂A的物质的量之比 溶质B的摩尔比的单位是1 在溶液中,表示溶质浓度的方法有: P206 例2

§4.3偏摩尔量 偏摩尔量的定义 偏摩尔量的加和公式 *偏摩尔量的求法 Gibbs-.Duhem公式 系统中偏摩尔量之间的关系
§4.3 偏摩尔量 偏摩尔量的定义 Gibbs-Duhem公式—— 系统中偏摩尔量之间的关系 偏摩尔量的加和公式 *偏摩尔量的求法
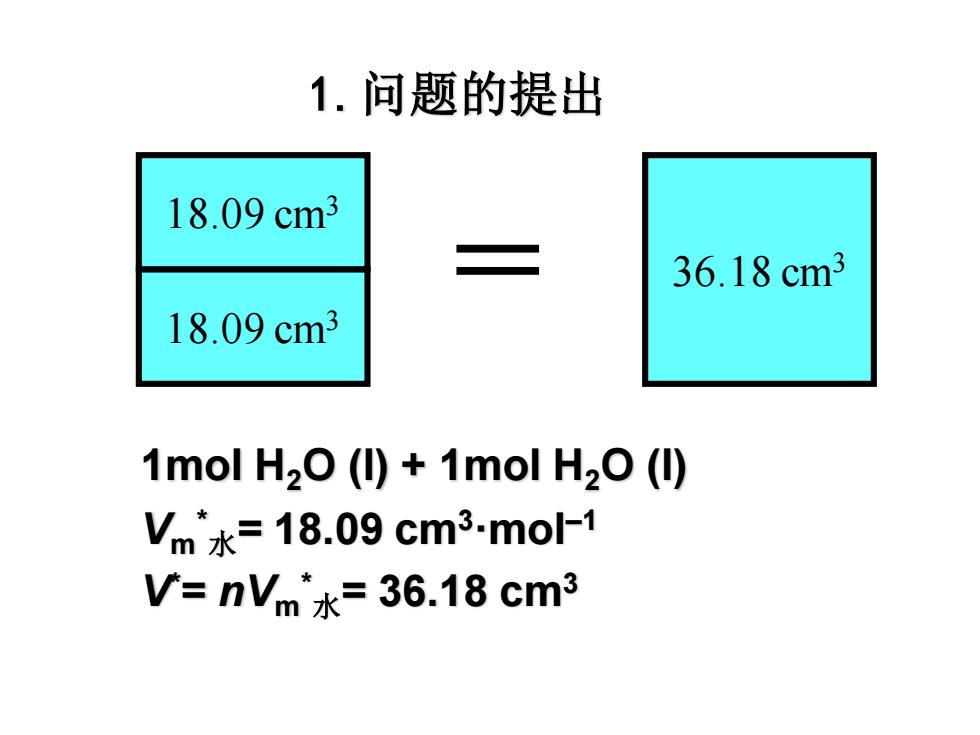
1.问题的提出 18.09cm3 36.18cm3 18.09cm3 1mol H2O (I)+1mol H2O(I) Vm水=18.09cm3.mo1 V=nVm水=36.18cm3
1.问题的提出 18.09 cm3 = 36.18 cm3 1mol H2O (l) + 1mol H2O (l) Vm * 水= 18.09 cm3·mol–1 V* = nVm * 水= 36.18 cm3 18.09 cm3