
热力学第一定律和热化学 ·可逆途径:P245
热力学第一定律和热化学 • 可逆途径:P245

热力学第一定律和热化学 二、焓() 设一封闭体系在变化中只做体积功,不做其它功, 则△=Q+W中W代表体积功:p△V个N/m2Xm3) W-FI-pSI--pAV △=Vz-V1 若体系变化是恒容过程(体积不变),即没有体积 功则W=0,△U=2, 2为恒容过程的热量,此式表示在不做体积功的 条件下体系在恒容过程中所吸收的热量全部用来增加 体系的内能
热力学第一定律和热化学 二、焓(H) 设一封闭体系在变化中只做体积功,不做其它功, 则U=Q+W中W代表体积功:-pV(N/m2×m3 ) W=Fl=pSl=-pV V=V2 -V1 若体系变化是恒容过程(体积不变),即没有体积 功则W=0,U=Qv Qv为恒容过程的热量,此式表示在不做体积功的 条件下体系在恒容过程中所吸收的热量全部用来增加 体系的内能

热力学第一定律和热化学 如果体系变化是恒压过程即p为定值,V由V,变成 V2, 2,表示恒压过程的热量(V>V,时是体系对环境做 功W为负,反之亦然)。 △U=Qp+W=2pp(V2V) U-U-2pP(V2-VD)-QpPV2+PVI 2p=(U2+pV2)-(U+pV) 八p、V都是体系的状态函数,它们的组合 (U+p)也是状态函数在热力学上将(U+p)定义为新 的状态函数,叫做焓,用H来表示:它具有广度性质。 H=U+pV Qp=(U2+pV2)-(U+pV )=H2-H=AH 因内能U的绝对值无法测,所以H的绝对值亦无 法测,我们也只研究焓变(△)
热力学第一定律和热化学 如果体系变化是恒压过程即p为定值,V由V1变成 V2,Qp表示恒压过程的热量(V2>V1时是体系对环境做 功W为负,反之亦然)。 U=Qp+W=Qp -p(V2 -V1 ) U2 -U1 =Qp -p(V2 -V1 )=Qp -pV2 +pV1 Qp=(U2 +pV2 )-(U1 +pV1 ) U、p、V都是体系的状态函数,它们的组合 (U+pV)也是状态函数在热力学上将(U+pV)定义为新 的状态函数,叫做焓,用H来表示:它具有广度性质。 H=U+pV Qp=(U2 +pV2 )-(U1 +pV1 )=H2 -H1 =H 因内能U的绝对值无法测,所以H的绝对值亦无 法测,我们也只研究焓变(H)

热力学第一定律和热化学 对于一封闭体系,在恒压和不做其它功的条件 下变化时,所吸收的热量全部用以使体系的焓的增 加,决不能把焓误认为是体系中所含的热量。 我们可以从体系和环境间的热量传递来恒量体 系内部焓的变化。 如果化学反应的△H为正值,表示体系从环境吸 收热能,称此反应为吸热反应。即: ∑H反应物∑H生成物 ∑AH生成物二反应物0 如果化学反应的△H为负值,则表示体系放热给 环境,称此反应为放热反应。即: ∑H反应物>∑H生成物 ∑△H(生成物一反应物<0
热力学第一定律和热化学 对于一封闭体系,在恒压和不做其它功的条件 下变化时,所吸收的热量全部用以使体系的焓的增 加,决不能把焓误认为是体系中所含的热量。 我们可以从体系和环境间的热量传递来恒量体 系内部焓的变化。 如果化学反应的H为正值,表示体系从环境吸 收热能,称此反应为吸热反应。即: ∑H反应物<∑H生成物 ∑H(生成物-反应物)>0 如果化学反应的H为负值,则表示体系放热给 环境,称此反应为放热反应。即: ∑H反应物>∑H生成物 ∑H(生成物-反应物)<0
热力学第一定律和热化学 如:2Hg0(s)==2Hg(0)+02(g)△He=+181.4kmo1 此反应为吸热反应 2H,(g)+02(g)==2H,0①)△He=-571.6kJmo1 此反应为放热反应 2molH2 1molO2 2molHg 1molO2 2molHgO 2molH2O
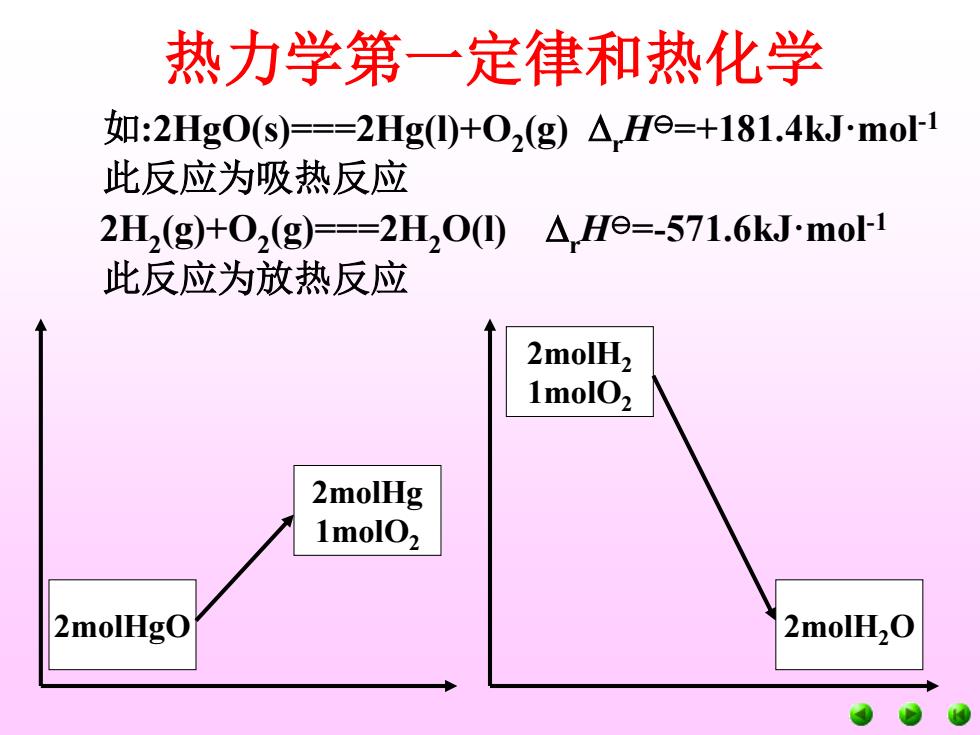
热力学第一定律和热化学 如:2HgO(s)===2Hg(l)+O2 (g) rH=+181.4kJ·mol-1 此反应为吸热反应 2H2 (g)+O2 (g)===2H2O(l) rH=-571.6kJ·mol-1 此反应为放热反应 2molHgO 2molHg 1molO2 2molH2O 2molH2 1molO2