
第七章 沉淀滴法 ·7.1概述 。7.2银量法 ·7.3银量法的应用 月
第七章 沉淀滴定法 • 7.1 概述 • 7.2 银量法 • 7.3 银量法的应用

● 7.1概述 ·沉淀滴定: ·是以沉淀反应为基础的滴定分析法 ·沉淀反应应满足下述条件: (1)沉淀溶解度小且组成恒定 ● (2)反应速率要快 ● (3)沉淀的吸附不妨碍化学计量点的确定 (4)有适当的方法确定计量点 ①
• 7.1 概述 • 沉淀滴定: • 是以沉淀反应为基础的滴定分析法 • 沉淀反应应满足下述条件: • (1)沉淀溶解度小且组成恒定 • (2)反应速率要快 • (3)沉淀的吸附不妨碍化学计量点的确定 • (4)有适当的方法确定计量点
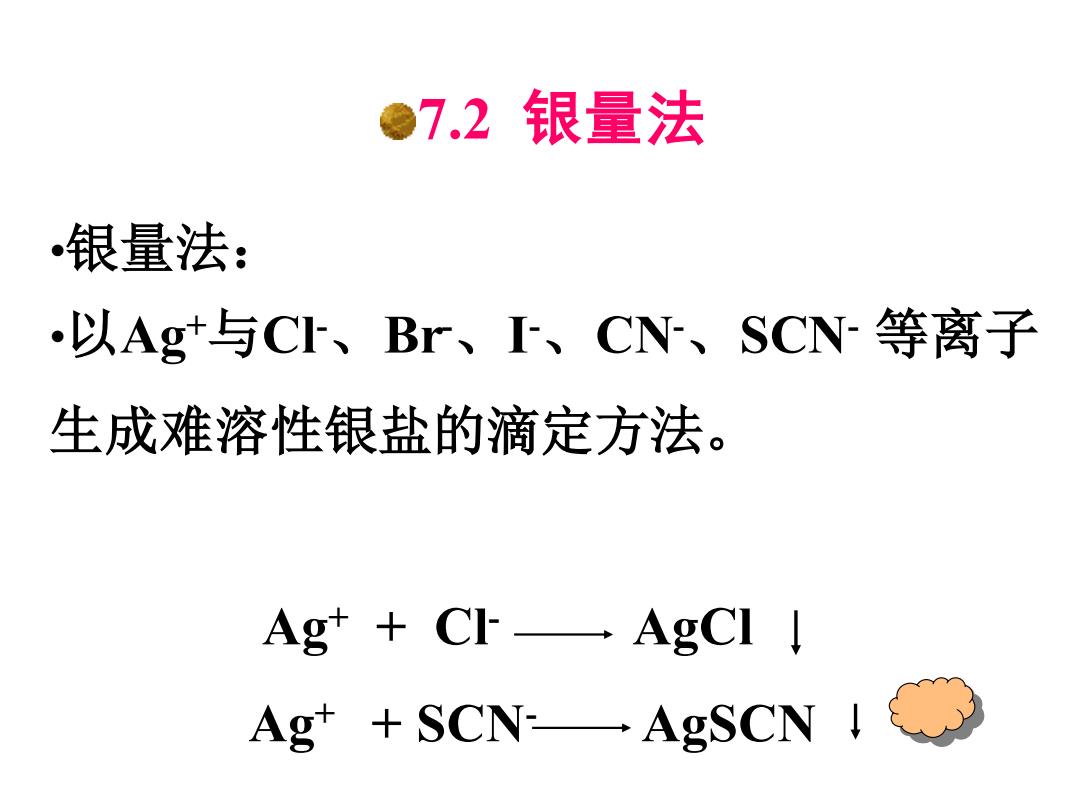
●72银量法 银量法: ·以Ag+与C、Br、、CN、SCN-等离子 生成难溶性银盐的滴定方法。 Ag+CI AgCI Ag+SCN一AgSCN↓}
7.2 银量法 •银量法: •以Ag+与Cl-、Br-、I -、CN-、SCN- 等离子 生成难溶性银盐的滴定方法。 Ag+ + Cl- AgCl Ag+ + SCN- AgSCN

·7.2.1滴定曲线 以0.100mol/LAgNO,标准溶液滴定 ·20.00mL0.100mol/L NaCl溶液为例 (1)滴定前 ·溶液中c(Cr)决定于NaCI浓度 ·c(Cr)=0.100mol/L pCl-lgc(CH)=1.00
• 7.2.1滴定曲线 • 以0.100mol/LAgNO3标准溶液滴定 • 20.00mL0.100mol/L NaCl溶液为例 (1) 滴定前 • 溶液中c(Cl- )决定于NaCl浓度 • c(Cl- )=0.100 mol/L pCl=-lgc(Cl- )=1.00

(2)滴定开始至化学计量点前 c(C)决定于剩余aCI浓度 e(Cr)=1 V(NaCD)-V(AgNO)(NaCD) V(NaCl)+V(AgNO) 当滴入AgN03溶液18.00mL、19.80mL 时,pC1值分别为2.28、3.30,当滴入 AgNO3溶液19.98ml时,溶液的pCl值为 4.30
(2)滴定开始至化学计量点前 •c(Cl- )决定于剩余NaCl浓度 • 当滴入AgNO3溶液18.00 mL、19.80 mL 时,pCl值分别为2.28、3.30,当滴入 AgNO3溶液19.98 ml时,溶液的pCl值为 4.30。 ( ) ( ) ( ) ( ) ( ) ( ) 3 3 V NaCl V AgNO V NaCl V AgNO c NaCl c C l + − = −