
Acid ionization constant 电离常数表使用说明 H内 104 -1 M NaOH K值越大,酸性越强。 10 13 碱性 10 12 K值大于1的酸叫强酸 氨水 1011 11 (家庭清洁剂) (Strong acid,K值小于1的 10t0 10 109 酸叫弱酸(Yeak acid)。 108 血液 中性 107 纯水 2. 表中的K9值跨越24个数量级,常 106 牛奶 使用更方便的常数pK代替。 10 10 10 醋 pK=-lgkg 柠檬汁 酸性 102 胃 pH =-Ig{c(H3O+)/mol-dm-3) 10t pOH =-Ig{c(OH-)/mol-dm-3) 上页 下页 目录 返回
1. 值越大,酸性越强。 值 大 于 1 的 酸 叫 强 酸 (Strong acid), 值小于1的 酸叫弱酸(Weak acid)。 θ Ka θ Ka θ Ka 2. 表中的 值跨越24个数量级,常 使用更方便的常数 代替。 θ Ka θ pKa pH = -lg{c(H3O+)/mol·dm-3} pOH =-lg{c(OH-)/mol·dm-3} θ a θ a pK lgK
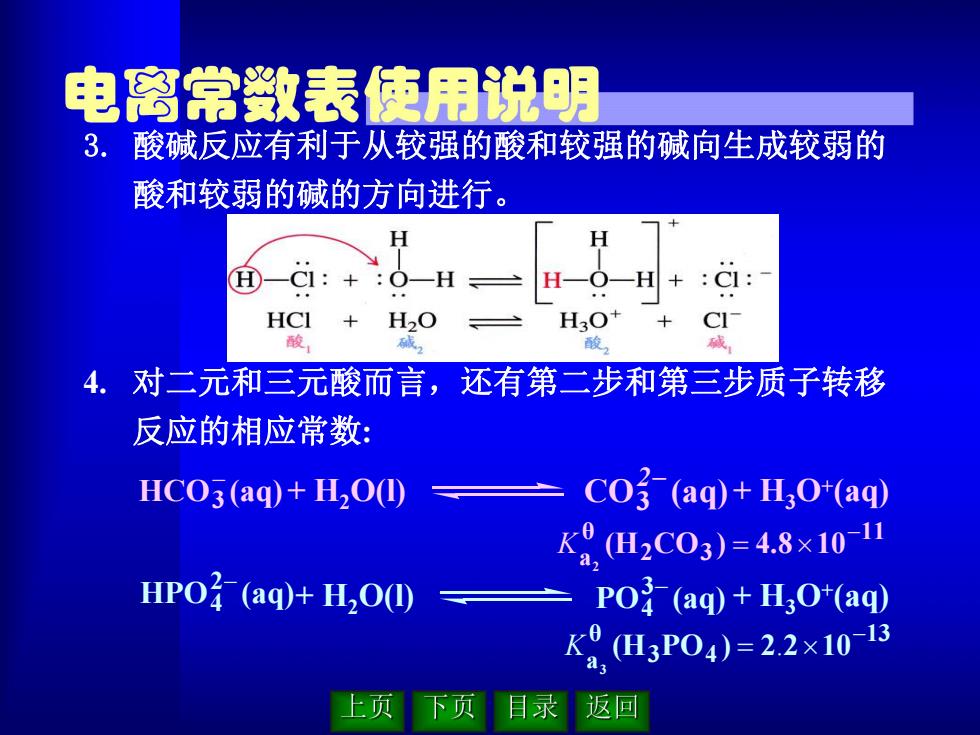
电离常数表使用说明 3.酸碱反应有利于从较强的酸和较强的碱向生成较弱的 酸和较弱的碱的方向进行。 -C1:+ -H H-O-H+:Cl: HCI H2O H3O+ CI 酸, 酸 碱 4. 对二元和三元酸而言,还有第二步和第三步质子转移 反应的相应常数: HC03(aq)+H00⑩ CO3(aq)+H3O*(aq) K9H2C03)=4.8×10- HP0子(aq)+H,0⑩ Po子(aq)+H,O*(aq HP0)=22x10-15 上页 下页目录 返回
3. 酸碱反应有利于从较强的酸和较强的碱向生成较弱的 酸和较弱的碱的方向进行。 4. 对二元和三元酸而言,还有第二步和第三步质子转移 反应的相应常数: + H2O(l) + H3O+ HPO (aq) (aq) 2 4 PO (aq) 3 4 13 3 4 θ a (H PO ) 2 2 10 3 K . + H2O(l) + H3O+ HCO (aq) (aq) 3 CO (aq) 3 2 11 2 3 θ a (H CO ) 4.8 10 2 K
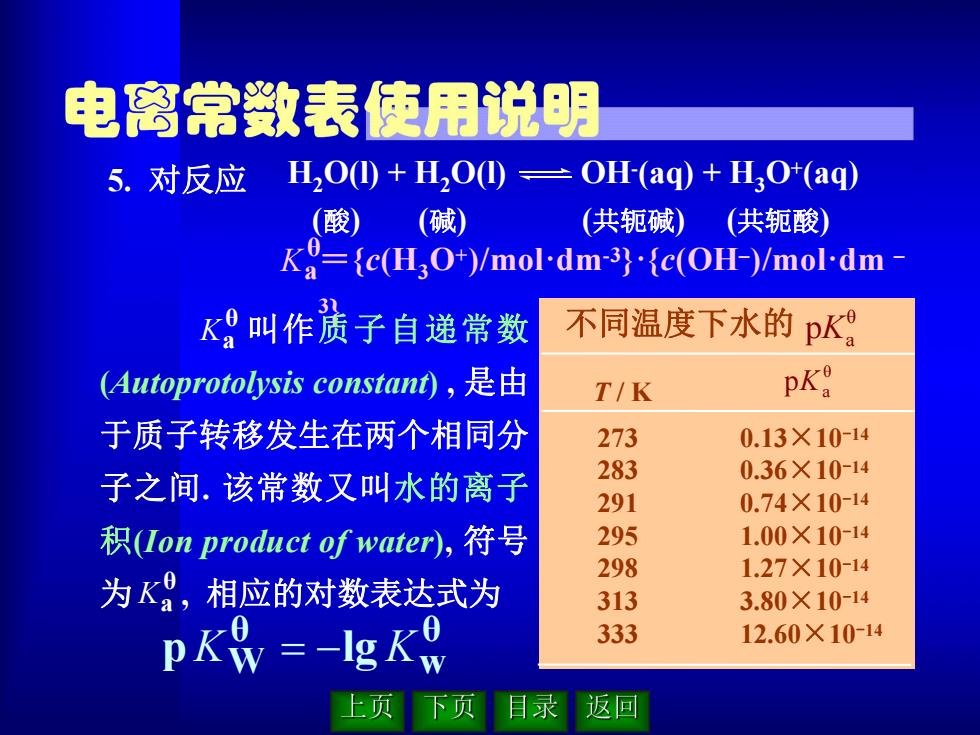
电离常数表使用说明 5.对反应 H2O①+HO①=OH(aq)+HO(aq) (酸) (碱) (共轭碱) (共轭酸) K={c(H3O+)/mol-dm-3){c(OH-)/mol-dm K叫作责子自递常数 不同温度下水的pK (Autoprotolysis constant),是由 T/K pKa 于质子转移发生在两个相同分 273 0.13×10-14 283 0.36×10-14 子之间.该常数又叫水的离子 291 0.74×10-14 积(Ion product of water)),符号 295 1.00×10-14 298 1.27×10-14 为K,相应的对数表达式为 313 3.80×10-14 pKy =-IgKo 333 12.60×10-14 上页 习 区回
T / K θ a pK 273 283 291 295 298 313 333 0.13×10-14 0.36×10-14 0.74×10-14 1.00×10-14 1.27×10-14 3.80×10-14 12.60×10-14 不同温度下水的 θ pKa 5. 对反应 θ Ka ={c(H3O+)/mol·dm-3}·{c(OH–)/mol·dm – 3} H2O(l) + H2O(l) OH-(aq) + H3O+(aq) (酸) (碱) (共轭碱) (共轭酸) θ w θ pKW lg K 叫作质子自递常数 (Autoprotolysis constant) , 是由 于质子转移发生在两个相同分 子之间. 该常数又叫水的离子 积(Ion product of water), 符号 为 , 相应的对数表达式为 θ Ka θ Ka
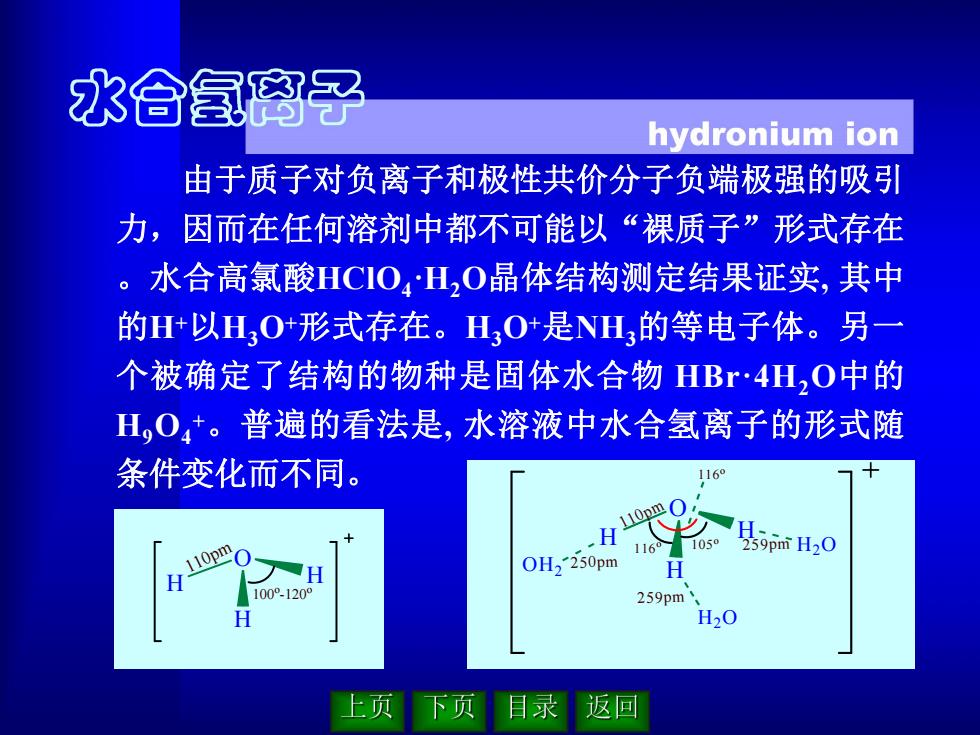
水合氢离子 hydronium ion 由于质子对负离子和极性共价分子负端极强的吸引 力,因而在任何溶剂中都不可能以“裸质子”形式存在 。水合高氯酸HCO4H2O晶体结构测定结果证实,其中 的H+以HO形式存在。HO是NH的等电子体。另一 个被确定了结构的物种是固体水合物HBr·4H2O中的 H,O4*。普遍的看法是,水溶液中水合氢离子的形式随 条件变化而不同。 1169 110pm H 1 105 259pmH20 OH2 250pm 100°-1209 259pm H20 上页 下页目录返回
由于质子对负离子和极性共价分子负端极强的吸引 力,因而在任何溶剂中都不可能以“裸质子”形式存在 。水合高氯酸HClO4·H2O晶体结构测定结果证实, 其中 的H+以H3O+形式存在。H3O+是NH3的等电子体。另一 个被确定了结构的物种是固体水合物 HBr·4H2O中的 H9O4 + 。普遍的看法是, 水溶液中水合氢离子的形式随 条件变化而不同。 O H H H 110pm 100 o -120 o O H H H 110pm 105 o OH2 250pm 116 o 116 o H2O H2O 259pm 259pm
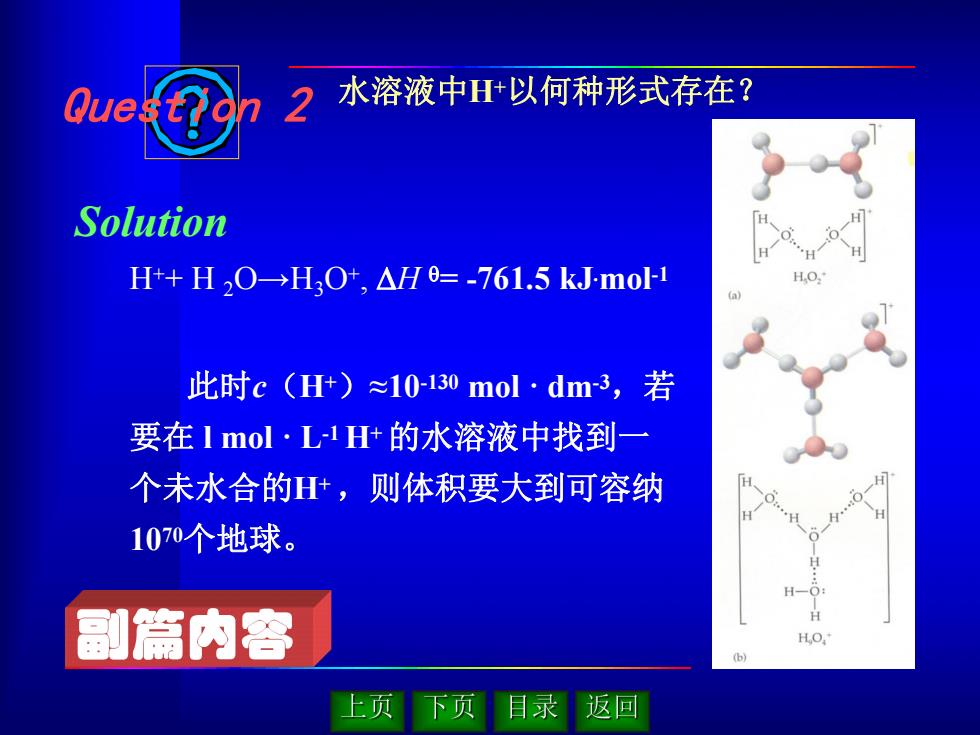
Que. 2 水溶液中H+以何种形式存在? Solution H+H,O→H3O+,△H=-761.5kJmo1 此时c(H+)≈10130mol·dm3,若 要在1mol·L1H+的水溶液中找到一 个未水合的H,则体积要大到可容纳 1070个地球。 副篇内容 ● 上页 下页 目录 返回
此时c(H+)≈10-130 mol · dm-3,若 要在 l mol · L-1 H+的水溶液中找到一 个未水合的H+ ,则体积要大到可容纳 1070个地球。 H++ H 2O→H3O+ , DH q= -761.5 kJ .mol -1 水溶液中H+以何种形式存在? Question 2 Solution