
固相反应 本章基本要求 1.了解固相反应的定义和分类方法 2.(重难点)熟练掌握Ellingham图中各个坐标、斜率和截距的物理含义,能利用 Ellingham图解决实际问题. 3.了解一种固态物质的四类反应,了解一级相变和二级相变的基本概念 4.掌握固固反应和固气反应的基本模型,知道扩散在固相反应中的重要地位. 5.(重难点)熟练掌握两种氧化物间的固相反应机理,掌握Jost模型和Wagner模 型,能准确计算Kirkendall比. 6.(重难点)熟练掌握固相反应的动力学推导过程.对于反应动力学控制的反应, 熟练掌握球形、立方体、长圆柱和板状颗粒的转化率方程;对于扩散动力学控制的反 应,熟练掌握平板接触反应的方程和粉末反应的Jander方程和Gingsting方程,了解 Carter方程. 7.了解固相反应的影响因素和低温固相反应 5.1引言 1.固相反应(solid state reactions) 有固态物质参加的反应,即至少有一种反应物为固态物质的反应。 2.固相反应法(solid state reaction route) 气相除外,原料全是或几乎全是固态物质一种材料合成或制备的方法. 3.固相反应的分类 (1)按物质状态:纯固相反应、有液相参加的反应、有气相参加的反应; (②)按反应性质:加成反应、交换反应、热分解反应、氧化反应、还原反应 的
5 固相反应 本章基本要求 1. 了解固相反应的定义和分类方法. 2.(重难点)熟练掌握 Ellingham 图中各个坐标、斜率和截距的物理含义,能利用 Ellingham 图解决实际问题. 3. 了解一种固态物质的四类反应,了解一级相变和二级相变的基本概念. 4. 掌握固-固反应和固-气反应的基本模型,知道扩散在固相反应中的重要地位. 5.(重难点)熟练掌握两种氧化物间的固相反应机理,掌握 Jost 模型和 Wagner 模 型,能准确计算 Kirkendall 比. 6.(重难点)熟练掌握固相反应的动力学推导过程.对于反应动力学控制的反应, 熟练掌握球形、立方体、长圆柱和板状颗粒的转化率方程;对于扩散动力学控制的反 应,熟练掌握平板接触反应的方程和粉末反应的 Jander 方程和 Gingsting 方程,了解 Carter 方程. 7. 了解固相反应的影响因素和低温固相反应 5.1 引言 1. 固相反应(solid state reactions) 有固态物质参加的反应,即至少有一种反应物为固态物质的反应. 2. 固相反应法(solid state reaction route) 气相除外,原料全是或几乎全是固态物质一种材料合成或制备的方法. 3. 固相反应的分类 (1)按物质状态:纯固相反应、有液相参加的反应、有气相参加的反应; (2)按反应性质:加成反应、交换反应、热分解反应、氧化反应、还原反应; 63

-64 5固相反应 (3)按反应机理:化学反应速率控制过程、化学反应速率控制过程、扩散控制过程 4.影响固-固反应的因素 (1)热力学因素:给定反应条件(温度、压力)下,生成物是否为稳定相 (2)动力学因素:由于固体的扩散速率很慢,绝大多数固相合成反应为扩散控制反 应.因此,固态反应物的结构、粒度、孔隙率、反应物之间的接触面积(装紧密度)及 取向是影响固固反应速率的重要因素,缩短扩散距离和提高扩散速度是提高反应速率 和缩短反应时间的重要手段, 5.2周相反应的热力学 1.驱动力 (1)化学势或电化学势梯度:固相反应总伴随有晶体物相中物质(原子或离子)的 局部输运,扩散前后原子或离子的电子构型有明显变化,它与原子或离子的化学势或电 化学势变化有关; h-() (5.2.1) i=4:十oF (5.2.2) (2)温度:固溶体的分离现象(demix): (3)外电场:离子晶体在外电场下的电解 (4)表面张力:固相烧结, 2.van'tHoff规则 对于反应物和生成物都是固相的纯固相反应,总是往放热(△H<0)的方向进行. 当固相反应中有液相或气相参与时,van't Hoff规则不适用. 3.Ellingham图 (1)横坐标:T,单位:K; (2)纵坐标:△G=Tnpo,单位:kJ/molO2 (3)斜率和截距 由自由能的定义式△G=△H-T△S,因此曲线的斜率为熵变△S,截距为0K时 的△H,即标准摩尔生成格.由于Ellingham图中的氧气系数都规定为1,因此大部分 反应的斜率大致相同. (4)相变点:斜率突变点 (5)如果△G>0,该物质不稳定,易分解成金属和氧气 (6)金属单质的活泼性更强,对应的Ellingham图更靠下 (7)对于不同氧气分压,从(OK,k)点向对应压力连线,通过交点找到反应温度 (8)对于有水、二氧化碳等参与的反应,分别从H点和C点出发与对应分压连线, 由于生成水和二氧化碳的反应都有各自的标准摩尔生成格,因此起点不是(OK,0k)点
− 64 − 5 固相反应 (3)按反应机理:化学反应速率控制过程、化学反应速率控制过程、扩散控制过程. 4. 影响固-固反应的因素 (1)热力学因素:给定反应条件(温度、压力)下,生成物是否为稳定相; (2)动力学因素:由于固体的扩散速率很慢,绝大多数固相合成反应为扩散控制反 应.因此,固态反应物的结构、粒度、孔隙率、反应物之间的接触面积(装紧密度)及 取向是影响固-固反应速率的重要因素,缩短扩散距离和提高扩散速度是提高反应速率 和缩短反应时间的重要手段. 5.2 固相反应的热力学 1. 驱动力 (1)化学势或电化学势梯度:固相反应总伴随有晶体物相中物质(原子或离子)的 局部输运,扩散前后原子或离子的电子构型有明显变化,它与原子或离子的化学势或电 化学势变化有关; µi = !∂G ∂ni " p,T,nj!=ni , (5.2.1) ηi = µi + ziφF. (5.2.2) (2)温度:固溶体的分离现象(demix); (3)外电场: 离子晶体在外电场下的电解; (4)表面张力:固相烧结. 2. van’t Hoff 规则 对于反应物和生成物都是固相的纯固相反应,总是往放热(∆H < 0)的方向进行. 当固相反应中有液相或气相参与时,van’t Hoff 规则不适用. 3. Ellingham 图 (1)横坐标:T,单位:K; (2)纵坐标:∆G = RTHMpP2,单位:kJ/mol O2; (3)斜率和截距 由自由能的定义式 ∆G = ∆H − T ∆S,因此曲线的斜率为熵变 ∆S,截距为 0K 时 的 ∆H,即标准摩尔生成焓.由于 Ellingham 图中的氧气系数都规定为 1,因此大部分 反应的斜率大致相同. (4)相变点:斜率突变点; (5)如果 ∆G > 0,该物质不稳定,易分解成金属和氧气; (6)金属单质的活泼性更强,对应的 Ellingham 图更靠下; (7)对于不同氧气分压,从 (0K, 0kJ) 点向对应压力连线,通过交点找到反应温度; (8)对于有水、二氧化碳等参与的反应,分别从 H 点和 C 点出发与对应分压连线, 由于生成水和二氧化碳的反应都有各自的标准摩尔生成焓,因此起点不是 (0K, 0kJ) 点.
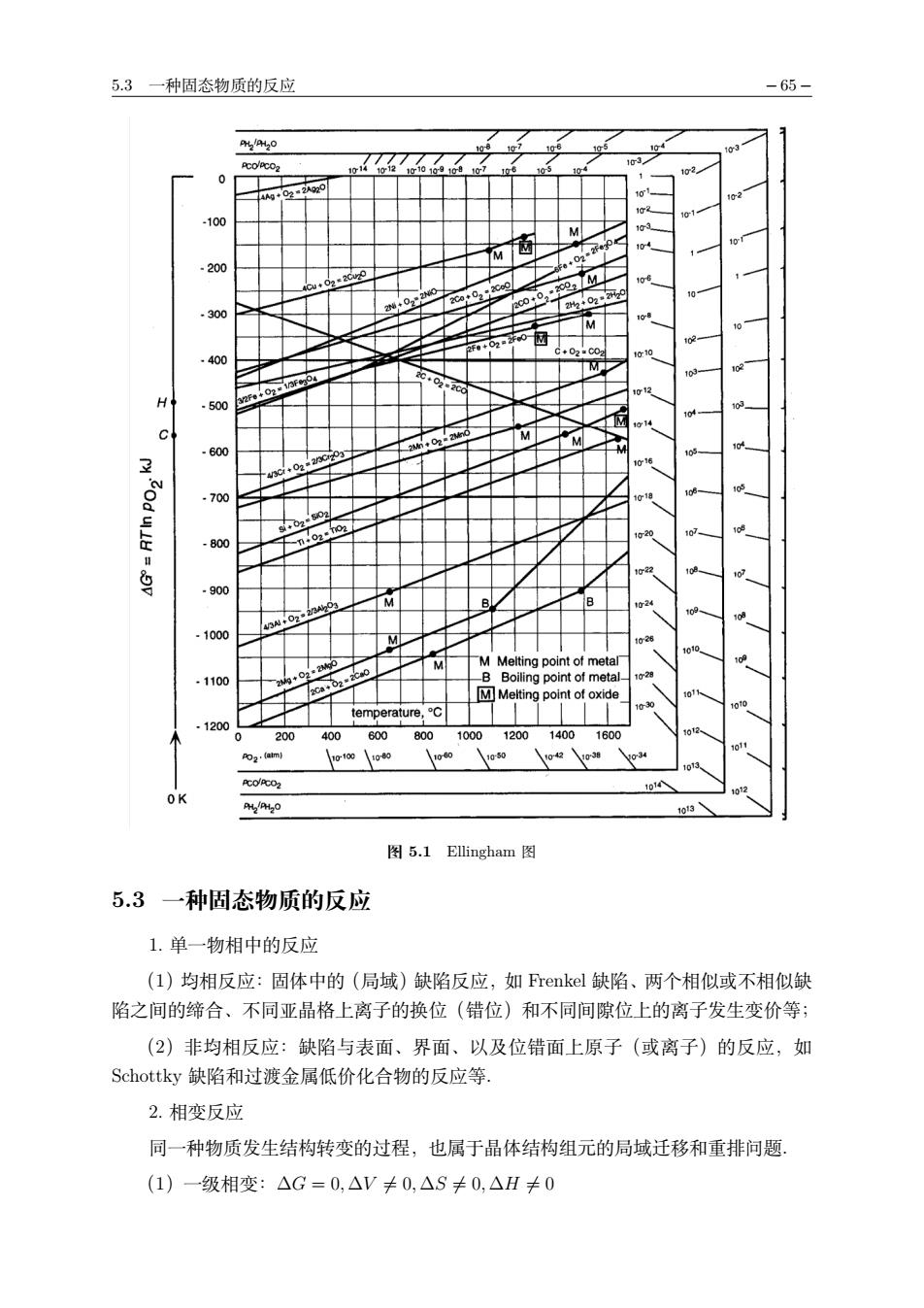
5.3一种固态物质的反应 %H0 p0 图5.1 Ellingham图 5.3一种固态物质的反应 1.单一物相中的反应 (1)均相反应:固体中的(局域)缺陷反应,如Frenkel缺陷、两个相似或不相似缺 陷之间的缔合、不同亚晶格上离子的换位(错位)和不同间隙位上的离子发生变价等; (2)非均相反应:缺陷与表面、界面、以及位错面上原子(或离子)的反应,如 Schottky缺陷和过渡金属低价化合物的反应等. 2.相变反应 同一种物质发生结构转变的过程,也属于晶体结构组元的局域迁移和重排问题 (1)一级相变:△G=0,△V≠0,△S≠0,△H≠0
5.3 一种固态物质的反应 − 65 − 图 5.1 Ellingham 图 5.3 一种固态物质的反应 1. 单一物相中的反应 (1)均相反应:固体中的(局域)缺陷反应,如 Frenkel 缺陷、两个相似或不相似缺 陷之间的缔合、不同亚晶格上离子的换位(错位)和不同间隙位上的离子发生变价等; (2)非均相反应:缺陷与表面、界面、以及位错面上原子(或离子)的反应,如 Schottky 缺陷和过渡金属低价化合物的反应等. 2. 相变反应 同一种物质发生结构转变的过程,也属于晶体结构组元的局域迁移和重排问题. (1)一级相变:∆G = 0, ∆V "= 0, ∆S "= 0, ∆H "= 0
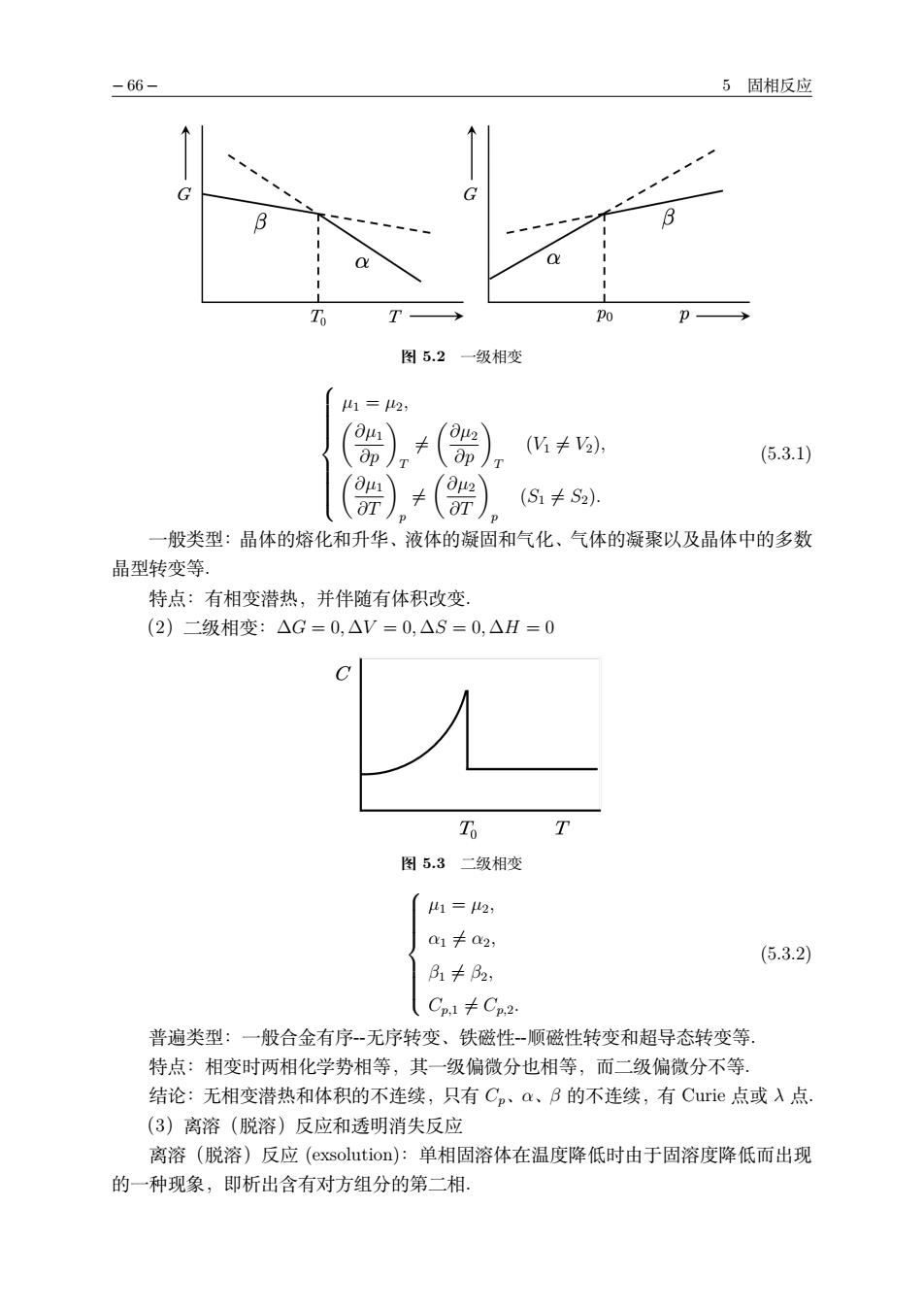
-66 5固相反应 图5.2一级相变 u1= (=)),(), (K≠2), (5.3.1) (S1≠S2) 一般类型:晶体的熔化和升华、液体的凝固和气化、气体的凝聚以及晶体中的多数 晶型转变等. 特点:有相变潜热,并伴随有体积改变 (2)二级相变:△G=0,△V=0,△S=0,△H=0 T 图5.3二级相变 1=2 a1卡a2 (5.3.2) lCpl≠Cp2 普遍类型:一般合金有序一无序转变、铁磁性-顺磁性转变和超导态转变等。 特点:相变时两相化学势相等,其一级偏微分也相等,而二级偏微分不等. 结论:无相变潜热和体积的不连续,只有C、a、B的不连续,有Curie点或入点 (3)离溶(脱溶)反应和透明消失反应 离溶(脱溶)反应(exsolution):单相固溶体在温度降低时由于固溶度降低而出现 的一种现象,即析出含有对方组分的第二相
− 66 − 5 固相反应 图 5.2 一级相变 µ1 = µ2, !∂µ1 ∂p " T "= !∂µ2 ∂p " T (V1 "= V2), !∂µ1 ∂T " p "= !∂µ2 ∂T " p (S1 "= S2). (5.3.1) 一般类型:晶体的熔化和升华、液体的凝固和气化、气体的凝聚以及晶体中的多数 晶型转变等. 特点:有相变潜热,并伴随有体积改变. (2)二级相变:∆G = 0, ∆V = 0, ∆S = 0, ∆H = 0 图 5.3 二级相变 µ1 = µ2, α1 "= α2, β1 "= β2, Cp,1 "= Cp,2. (5.3.2) 普遍类型:一般合金有序-无序转变、铁磁性-顺磁性转变和超导态转变等. 特点:相变时两相化学势相等,其一级偏微分也相等,而二级偏微分不等. 结论:无相变潜热和体积的不连续,只有 Cp、α、β 的不连续,有 Curie 点或 λ 点. (3)离溶(脱溶)反应和透明消失反应 离溶(脱溶)反应 (exsolution):单相固溶体在温度降低时由于固溶度降低而出现 的一种现象,即析出含有对方组分的第二相.
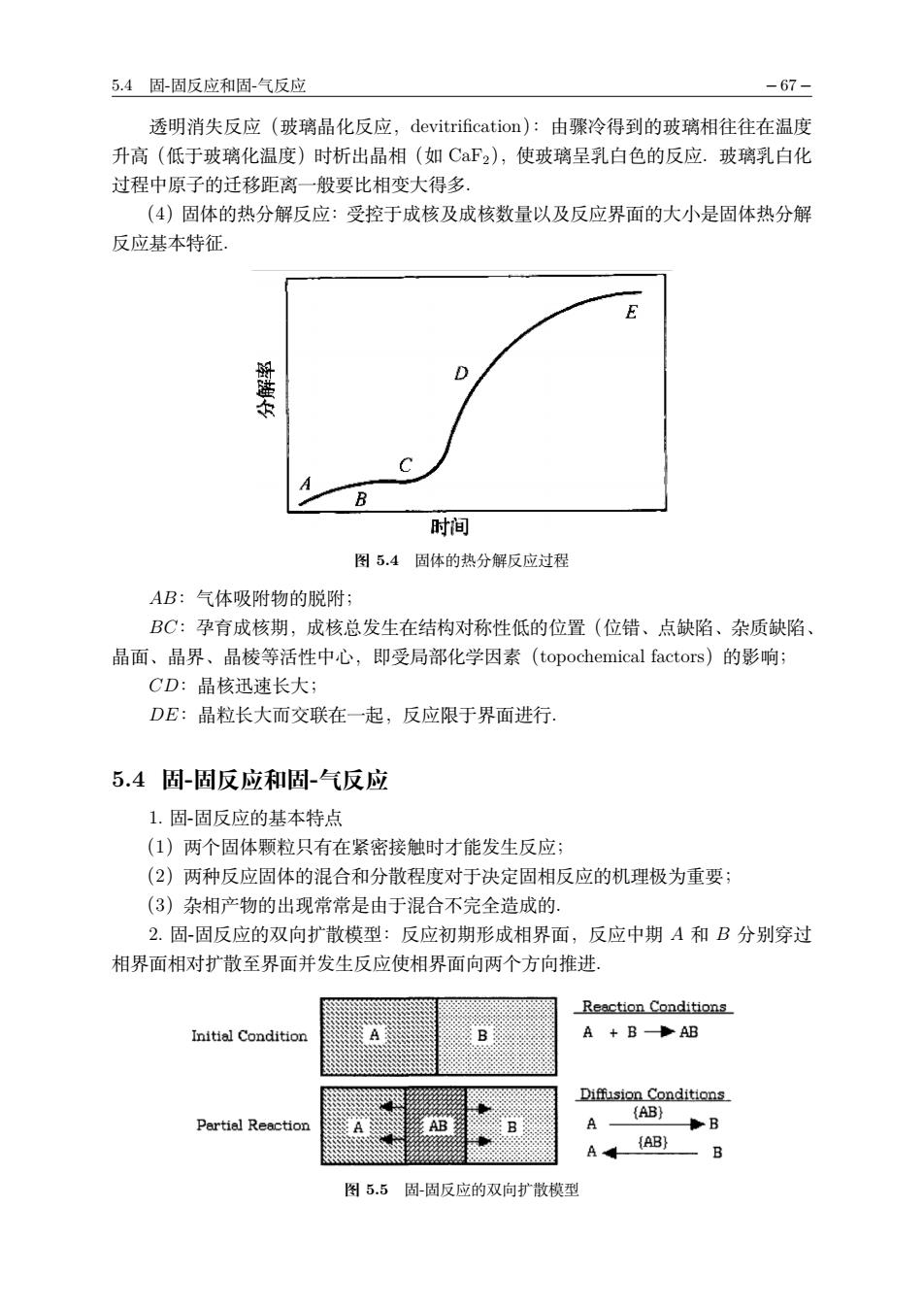
5.4固-周反应和周气反应 -67- 透明消失反应(玻璃晶化反应,devitrification):由骤冷得到的玻璃相往往在温度 升高(低于玻璃化温度)时析出晶相(如CaF2),使玻璃呈乳白色的反应.玻璃乳白化 过程中原子的迁移距离一般要比相变大得多. (4)固体的热分解反应:受控于成核及成核数量以及反应界面的大小是固体热分解 反应基本特征。 D C B 时间 图5.4固体的热分解反应过程 AB:气体吸附物的脱附; BC:孕育成核期,成核总发生在结构对称性低的位置(位错、点缺陷、杂质缺陷 晶面、晶界、晶棱等活性中心,即受局部化学因索(topochemical factors)的影响; CD:晶核迅速长大; DE:晶粒长大而交联在一起,反应限于界面进行 5.4固-固反应和周-气反应 1.固固反应的基本特点 (1)两个固体颗粒只有在紧密接触时才能发生反应; (2)两种反应固体的混合和分散程度对于决定固相反应的机理极为重要; (3)杂相产物的出现常常是由于混合不完全造成的, 2.固-固反应的双向扩散模型:反应初期形成相界面,反应中期A和B分别穿过 相界面相对扩散至界面并发生反应使相界面向两个方向推进. Reaction Conditions B A +BAB B B A(AB) 图55固-固反应的双向扩散模型
5.4 固-固反应和固-气反应 − 67 − 透明消失反应(玻璃晶化反应,devitrification):由骤冷得到的玻璃相往往在温度 升高(低于玻璃化温度)时析出晶相(如 CaF2),使玻璃呈乳白色的反应.玻璃乳白化 过程中原子的迁移距离一般要比相变大得多. (4)固体的热分解反应:受控于成核及成核数量以及反应界面的大小是固体热分解 反应基本特征. 图 5.4 固体的热分解反应过程 AB:气体吸附物的脱附; BC:孕育成核期,成核总发生在结构对称性低的位置(位错、点缺陷、杂质缺陷、 晶面、晶界、晶棱等活性中心,即受局部化学因素(topochemical factors)的影响; CD:晶核迅速长大; DE:晶粒长大而交联在一起,反应限于界面进行. 5.4 固-固反应和固-气反应 1. 固-固反应的基本特点 (1)两个固体颗粒只有在紧密接触时才能发生反应; (2)两种反应固体的混合和分散程度对于决定固相反应的机理极为重要; (3)杂相产物的出现常常是由于混合不完全造成的. 2. 固-固反应的双向扩散模型:反应初期形成相界面,反应中期 A 和 B 分别穿过 相界面相对扩散至界面并发生反应使相界面向两个方向推进. 图 5.5 固-固反应的双向扩散模型