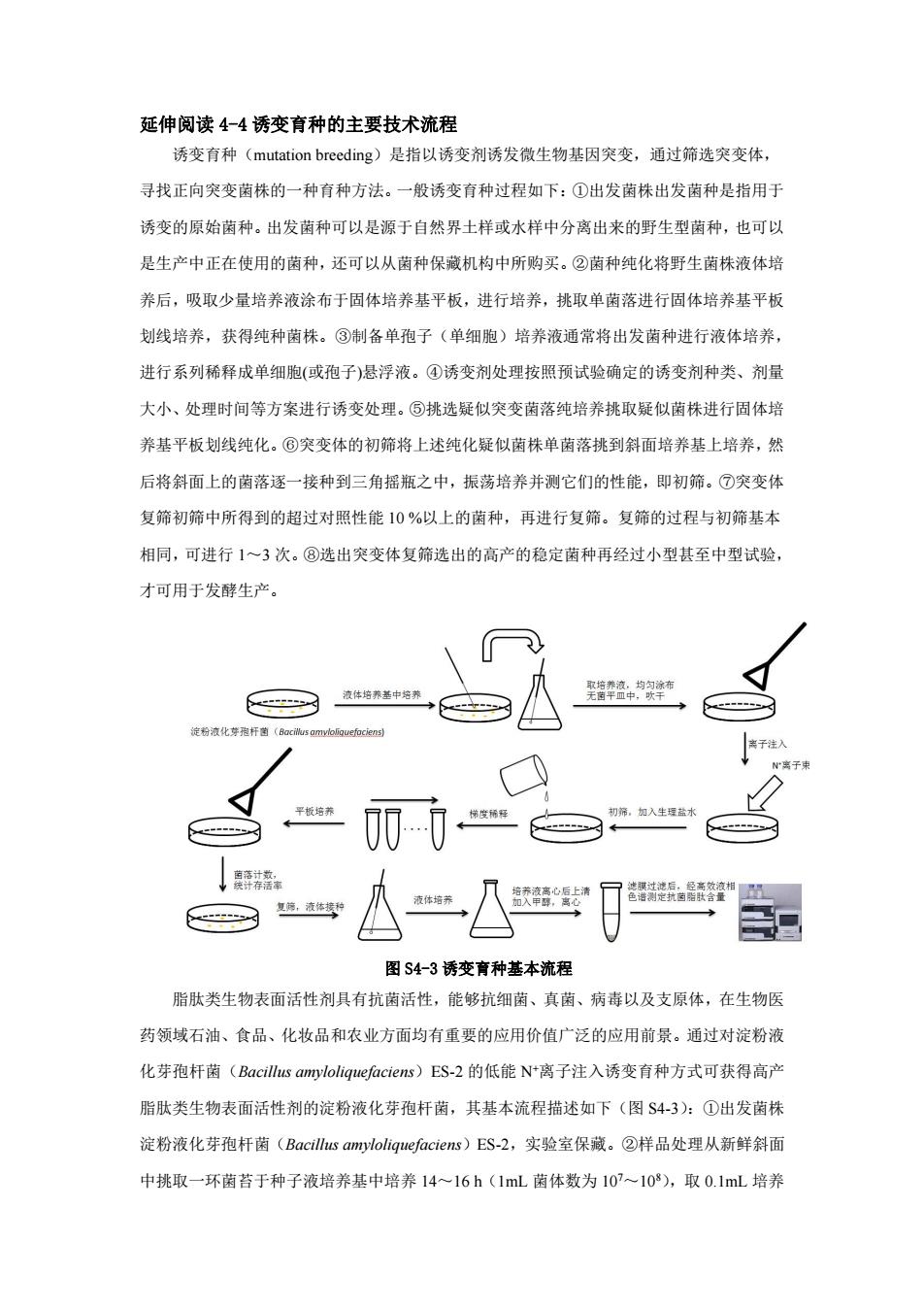
延伸阅读4-4诱变育种的主要技术流程 诱变育种(mutation breeding)是指以诱变剂诱发微生物基因突变,通过筛选突变体, 寻找正向突变菌株的一种育种方法。一般诱变育种过程如下:①出发菌株出发菌种是指用于 诱变的原始菌种。出发菌种可以是源于自然界土样或水样中分离出来的野生型菌种,也可以 是生产中正在使用的菌种,还可以从菌种保藏机构中所购买。②菌种纯化将野生菌株液体培 养后,吸取少量培养液涂布于固体培养基平板,进行培养,挑取单菌落进行固体培养基平板 划线培养,获得纯种菌株。③制备单孢子(单细胞)培养液通常将出发菌种进行液体培养, 进行系列稀释成单细胞(或孢子)悬浮液。④诱变剂处理按照预试验确定的诱变剂种类、剂量 大小、处理时间等方案进行诱变处理。⑤挑选疑似突变菌落纯培养挑取疑似菌株进行固体培 养基平板划线纯化。⑥突变体的初筛将上述纯化疑似菌株单菌落挑到斜面培养基上培养,然 后将斜面上的菌落逐一接种到三角摇瓶之中,振荡培养并测它们的性能,即初筛。⑦突变体 复筛初筛中所得到的超过对照性能10%以上的菌种,再进行复筛。复筛的过程与初筛基本 相同,可进行1~3次。⑧选出突变体复筛选出的高产的稳定菌种再经过小型甚至中型试验, 才可用于发酵生产。 液体培养基中培养 取培养液,均匀涂布 无茵平皿中,吹干 淀粉液化芽孢杆菌(Bacillus amvloliguefociens) 弟度稀释 初筛,加入生理益水 来液离心后上 逃过透后。经高效液相 复筛,液体携 甲碎,离心 图S4-3诱变育种基本流程 脂肽类生物表面活性剂具有抗菌活性,能够抗细菌、真菌、病毒以及支原体,在生物医 药领域石油、食品、化妆品和农业方面均有重要的应用价值广泛的应用前景。通过对淀粉液 化芽孢杆菌(Bacillus amyloliquefaciens)ES-2的低能N+离子注入诱变育种方式可获得高产 脂肽类生物表面活性剂的淀粉液化芽孢杆菌,其基本流程描述如下(图S4-3):①出发菌株 淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)ES-2,实验室保藏。②样品处理从新鲜斜面 中挑取一环菌苔于种子液培养基中培养14~16h(1mL菌体数为10~108),取0.1mL培养
延伸阅读 4-4 诱变育种的主要技术流程 诱变育种(mutation breeding)是指以诱变剂诱发微生物基因突变,通过筛选突变体, 寻找正向突变菌株的一种育种方法。一般诱变育种过程如下:①出发菌株出发菌种是指用于 诱变的原始菌种。出发菌种可以是源于自然界土样或水样中分离出来的野生型菌种,也可以 是生产中正在使用的菌种,还可以从菌种保藏机构中所购买。②菌种纯化将野生菌株液体培 养后,吸取少量培养液涂布于固体培养基平板,进行培养,挑取单菌落进行固体培养基平板 划线培养,获得纯种菌株。③制备单孢子(单细胞)培养液通常将出发菌种进行液体培养, 进行系列稀释成单细胞(或孢子)悬浮液。④诱变剂处理按照预试验确定的诱变剂种类、剂量 大小、处理时间等方案进行诱变处理。⑤挑选疑似突变菌落纯培养挑取疑似菌株进行固体培 养基平板划线纯化。⑥突变体的初筛将上述纯化疑似菌株单菌落挑到斜面培养基上培养,然 后将斜面上的菌落逐一接种到三角摇瓶之中,振荡培养并测它们的性能,即初筛。⑦突变体 复筛初筛中所得到的超过对照性能 10 %以上的菌种,再进行复筛。复筛的过程与初筛基本 相同,可进行 1~3 次。⑧选出突变体复筛选出的高产的稳定菌种再经过小型甚至中型试验, 才可用于发酵生产。 图 S4-3 诱变育种基本流程 脂肽类生物表面活性剂具有抗菌活性,能够抗细菌、真菌、病毒以及支原体,在生物医 药领域石油、食品、化妆品和农业方面均有重要的应用价值广泛的应用前景。通过对淀粉液 化芽孢杆菌(Bacillus amyloliquefaciens)ES-2 的低能 N+离子注入诱变育种方式可获得高产 脂肽类生物表面活性剂的淀粉液化芽孢杆菌,其基本流程描述如下(图 S4-3):①出发菌株 淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)ES-2,实验室保藏。②样品处理从新鲜斜面 中挑取一环菌苔于种子液培养基中培养 14~16 h(1mL 菌体数为 10 7~10 8),取 0.1mL 培养

液,均匀涂布无菌平皿中,吹干待用。③离子注入将上述样品培养皿叠放在对照培养皿上方, 一起放入离子注入机靶室,打开上方培养皿盖,靶室抽真空。用能量为20kVN+离子束处 理,注入剂量分别为1.30、2.08、2.0、3.90、5.20E1015cm2。④初筛取1mL无菌生理盐水 将离子注入后的菌膜洗下,梯度稀释,分别吸取不同梯度下稀释液0.1mL均匀涂布在初筛 平板上,37℃培养36,菌落计数,统计存活率。存活率=注入样品单菌落数/真空对照单菌 落数。从中挑选有较大透明圈的菌落作为复筛菌株。⑤复筛将初筛菌株进行液体发酵培养, 发酵液于4℃下10000g离心15min,获得上清液。加入适量的甲醇提取20min,离心,获 得甲醇提取液经0.22m滤膜过滤后,经高效液相色谱测定抗菌脂肽含量。规定脂肽含量高 与原始菌株5%的为正突变。⑥选出突变体获得一株稳定的高脂肽高产菌E$-2-4,发酵过程 中延滞期缩短了4h,稳定期长达20h,发酵至36h时脂肽产量达到最高,比原始菌株提高 了15.2%。 随着重组DNA技术的不断发展,微生物基因工程菌株的构建己经逐渐成为微生物育种 的一种常规和便利的方式,诱变育种这种微生物菌种选育的方式因其自己的不足已经逐渐被 基因工程育种技术所替代
液,均匀涂布无菌平皿中,吹干待用。③离子注入将上述样品培养皿叠放在对照培养皿上方, 一起放入离子注入机靶室,打开上方培养皿盖,靶室抽真空。用能量为 20keV N+离子束处 理,注入剂量分别为 1.30、2.08、2.60、3.90、5.20E10 15 cm-2。④初筛取 1mL 无菌生理盐水 将离子注入后的菌膜洗下,梯度稀释,分别吸取不同梯度下稀释液 0.1mL 均匀涂布在初筛 平板上,37℃培养 36h,菌落计数,统计存活率。存活率=注入样品单菌落数/真空对照单菌 落数。从中挑选有较大透明圈的菌落作为复筛菌株。⑤复筛将初筛菌株进行液体发酵培养, 发酵液于 4℃下 10000g 离心 15min,获得上清液。加入适量的甲醇提取 20 min,离心,获 得甲醇提取液经 0.22 μm 滤膜过滤后,经高效液相色谱测定抗菌脂肽含量。规定脂肽含量高 与原始菌株 5%的为正突变。⑥选出突变体获得一株稳定的高脂肽高产菌 ES-2-4,发酵过程 中延滞期缩短了 4 h,稳定期长达 20 h,发酵至 36 h 时脂肽产量达到最高,比原始菌株提高 了 15.2%。 随着重组 DNA 技术的不断发展,微生物基因工程菌株的构建已经逐渐成为微生物育种 的一种常规和便利的方式,诱变育种这种微生物菌种选育的方式因其自己的不足已经逐渐被 基因工程育种技术所替代