
山东理工大宴影响沉淀溶解度的因素1、同离子效应例:测SO42-,如加入的Ba2+量与SO.2-的量相等,则BaSO在水中溶解度:S =[SO42-] =[Ba 2+]= /K,, =1.0 ×10-' mol/L若加入过量Ba2+,使平衡时[Ba2+]=0.10 mol/LKspS =[SO.= 1.1×10- mo/L[Ba 2+ ]2025/4/5
2025/4/5 二、影响沉淀溶解度的因素 1、同离子效应 例: 测SO4 2-, 如加入的Ba2+量与SO4 2-的量相等,则BaSO4在水中溶 解度: [SO ] [Ba ] 1.0 10 mol/L 5 s p 2 2 4 − + − S = = = K = 若加入过量Ba2+ , 使平衡时[Ba2+]=0.10 mol/L 1.1 10 mol/L [Ba ] [SO ] 9 2 2 s p 4 − + − = = = K S

山东理工大客加入过量的沉淀剂利用同离子效应降低沉淀剂的溶解度:挥发性沉淀剂,过量50----100%非挥发性沉淀剂,过量20----30%2、盐效应一增大溶解度Kosp[M*][A-]= KspYM+Y沉淀剂过多,盐效应超过同离子效应,使沉淀溶解度增大,强电解质(KNO3,NaNO3)的加入使S增大的效应,高价离子?受影响较大,所以构晶离子电荷愈高盐效应影响越大
2025/4/5 加入过量的沉淀剂利用同离子效应降低沉淀剂的 溶解度: 挥发性沉淀剂,过量50 -100% 非挥发性沉淀剂,过量20-30% 2、盐效应—增大溶解度 - M A 0 [M ][A ] = = + + − s p s p K K 沉淀剂过多,盐效应超过同离子效应,使沉淀溶解 度增大,强电解质(KNO3,NaNO3 )的加入使S增大的效 应,高价离子γ受I影响较大,所以构晶离子电荷愈高, 盐效应影响越大
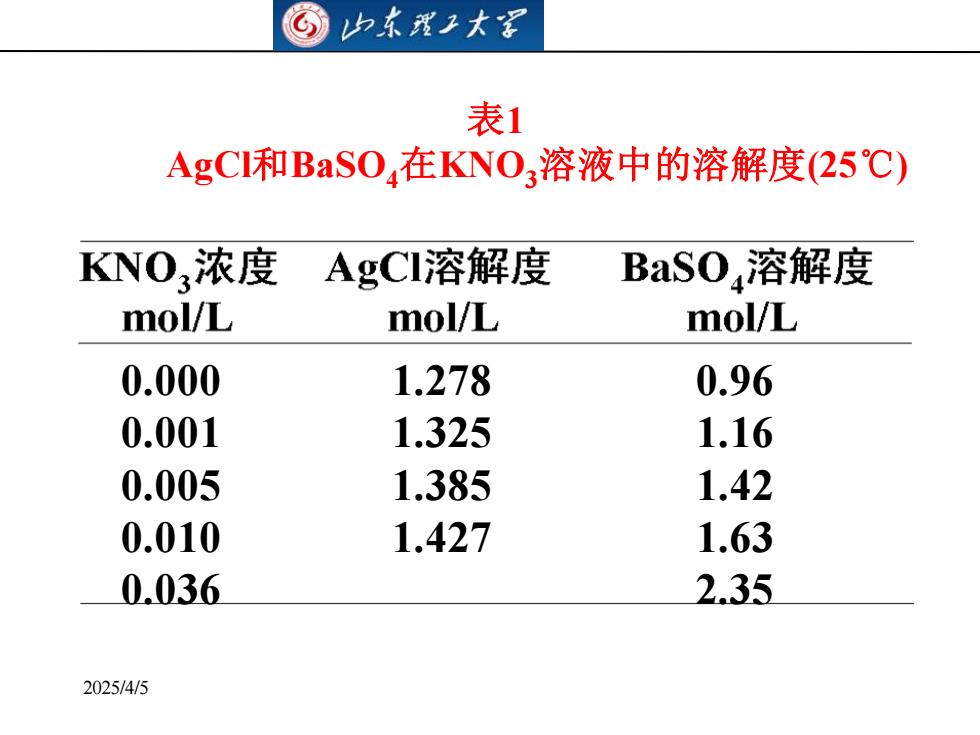
山东理工大茗表1AgCI和BaSO,在KNO,溶液中的溶解度(25℃)KNO,浓度AgCI溶解度BaSO,溶解度mol/Lmol/Lmol/L0.960.0001.2780.0011.3251.160.0051.421.3850.0101.631.4272.350.0362025/4/5
2025/4/5 0.000 1.278 0.96 0.001 1.325 1.16 0.005 1.385 1.42 0.010 1.427 1.63 0.036 2.35 表1 AgCl和BaSO4在KNO3溶液中的溶解度(25℃)

山东理工大3、酸效应溶液酸度对沉淀溶解度的影响,如弱酸根离子作为沉淀剂,由于[H+I使 S增大,CaC,O4 = Ca2+ + C,O 2↓H+HC,O4,H,C,OS =[C,042-]+[HC,04]+[H,C,04][C042-]=S.8C,042025/4/5
2025/4/5 3、酸效应 溶液酸度对沉淀溶解度的影响,如弱酸根离子作为 沉淀剂,由于 [H+ ]使 S增大. = − − 2 C2 O4 2 2 4 [C O ] S 2 2 4 - 2 4 2 2 4 2 2 4 HC O ,H C O H CaC O Ca C O + + − = + [C O ] [HC O ] [H C O ] 2 4 2 2 4 2 = 2 4 + + − − S

山东理工大客S=S.S.S[Ca2+ [C, O 2-] = Ks,C,042-C2042SKspS=KαSDspSαc,0 (H).0C[例2]CaC,0,Ksp=2.3 X 10-9(10-8.60), pKsp=8.64H,C,O4的 pKa1=1.25, pKa2=4.29, β,=1/Ka2=104.29β2=1/KaiKa2=105.54,求不同pH时的溶解度。2025/4/5
2025/4/5 ' s p C O s p s p C O 2 2 4 2 2 4 K K S = K = = − − sp 2 2 4 2 [Ca ][C O ] = K + − C O (H) 2 2 2 4 − = S [例2]CaC2O4Ksp=2.3×10-9 (10-8.60), pKsp=8.64 H2C2O4的pKa1=1.25, pKa2=4.29, β1=1/Ka2=104.29 β2=1/Ka1Ka2=105.54 ,求不同pH时的溶解度。 = − = 2− 2 4 2 2 4 C O 2 S S S C O