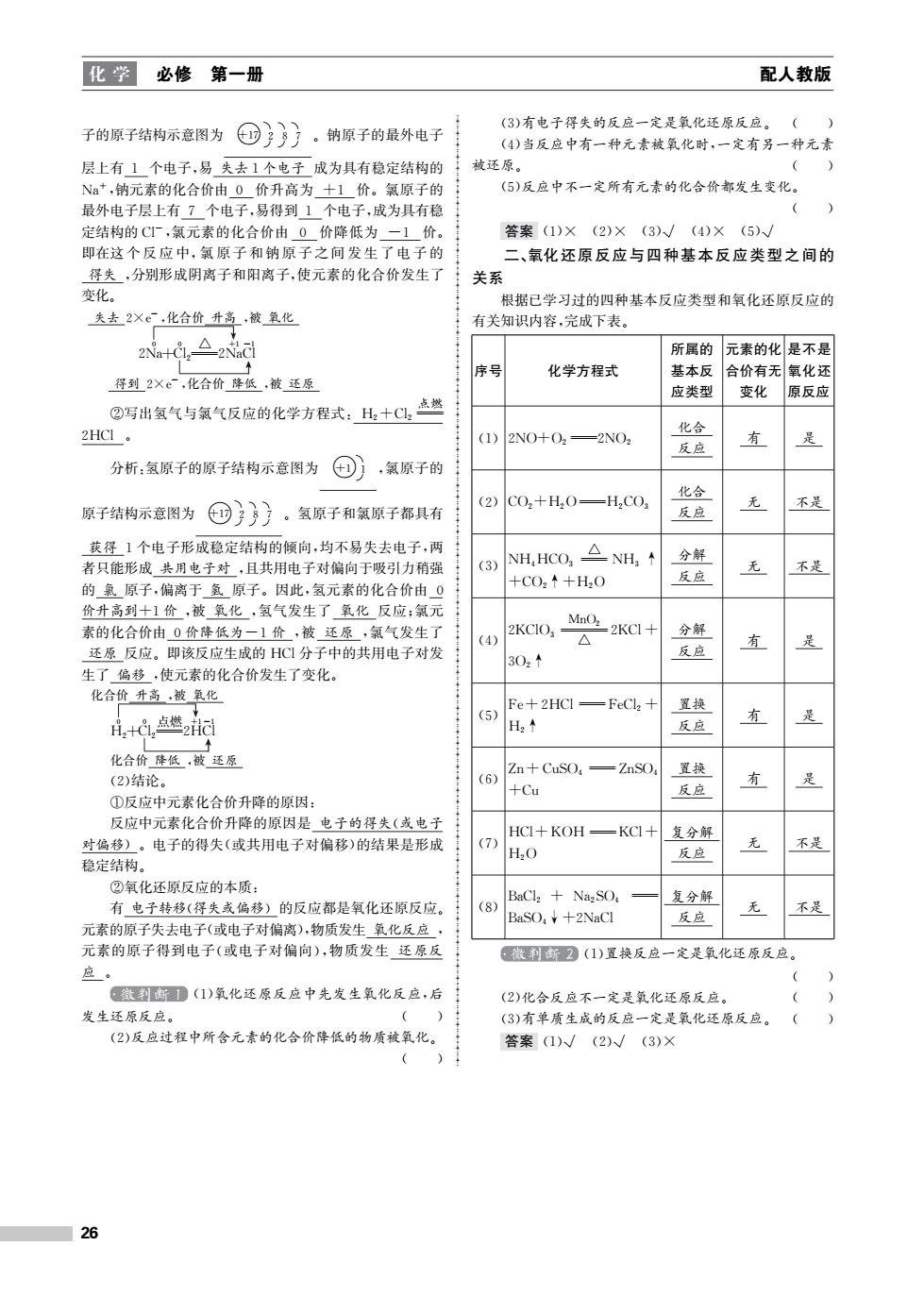
化学 必修 第一册 配人教版 (3)有电子得失的反应一定是氧化还原反应。() 子的原子结构示意图为 ①}》)。钠原子的最外电子 (4)当反应中有一种元素被氧化时,一定有另一种元素 层上有1个电子,易失去1个电子成为具有稳定结构的 被还原。 ( Na+,钠元素的化合价由0价升高为+1价。氯原子的 (5)反应中不一定所有元素的化合价都发生变化。 最外电子层上有7个电子,易得到1个电子,成为具有稳 定结构的CI厂,氯元素的化合价由0价降低为一1价。 答案(1)×(2)×(3)√(4)×(5)√/ 即在这个反应中,氯原子和钠原子之间发生了电子的 二、氧化还原反应与四种基本反应类型之间的 得失,分别形成阴离子和阳离子,使元素的化合价发生了 关系 变化。 根据已学习过的四种基本反应类型和氧化还原反应的 失去2Xe,化合价升高,被氧化 有关知识内容,完成下表。 △2a 所属的 元素的化是不是 序号 化学方程式 基本反 合价有无氧化还 得到2Xe,化合价降低,被还原 应类型 变化 原反应 ②写出氢气与氯气反应的化学方程式:H,十C,点燃 2HCI 化合 (1)2NO+O2=2NO2 有 反应 分析:氢原子的原子结构示意图为 ,氯原子的 化合 (2) 无 原子结构示意图为 ①》。氢原子和氯原子都具有 C02+H20—H2C03 不是 反应 获得1个电子形成稳定结构的倾向,均不易失去电子,两 NH,HCO,△NH,+ 分解 者只能形成共用电子对,且共用电子对偏向于吸引力稍强 (3) 无 不是 +CO2↑+H2O 反应 的氯原子,偏离于氢原子。因此,氢元素的化合价由0 价升高到十1价,被氧化,氢气发生了氧化反应:氯元 MnO2 素的化合价由0价降低为一1价,被还原,氯气发生了 2KCIO, =2KCI+ 分解 (4) △ 有 是 还原反应。即该反应生成的HCI分子中的共用电子对发 302↑ 反应 生了偏移,使元素的化合价发生了变化。 化合价升高,被氧化 Fe十2HCl=FeCl2t 置换 i,+C,点燃2冠 (5) 有 是 H2个 反应 化合价降低,被还原 Zn+CuSO=ZnSO 置换 (2)结论。 (6) 有 +Cu 反应 ①反应中元素化合价升降的原因: 反应中元素化合价升降的原因是电子的得失(或电子 HCI+KOH-KCI+ 复分解 对偏移)。电子的得失(或共用电子对偏移)的结果是形成 (7) 不是 H2O 反应 稳定结构。 ②氧化还原反应的本质: BaCl2+Na2SO 有电子转移(得失或偏移)的反应都是氧化还原反应。 复分解 (8) 无 不是 BaSO¥+2NaCl 反应 元素的原子失去电子(或电子对偏离),物质发生氧化反应, 元素的原子得到电子(或电子对偏向),物质发生还原反 微割断2(1)置换反应一定是氧化还原反应。 应。 ( 微判断1(1)氧化还原反应中先发生氧化反应,后 (2)化合反应不一定是氧化还原反应。 发生还原反应。 () (3)有单质生成的反应一定是氧化还原反应。 (2)反应过程中所含元素的化合价降低的物质被氧化。 答案(1)√(2)√(3)× 26
化 学 必修 第一册 配人教版 子的原子结构示意图为 ○+17 ◝ 2 ◞ ◝ 8 ◞ ◝ 7 ◞ 。钠原子的最外电子 层上有 1 个电子,易 失去1个电子 成为具有稳定结构的 Na+ ,钠元素的化合价由 0 价升高为 +1 价。氯原子的 最外电子层上有 7 个电子,易得到 1 个电子,成为具有稳 定结构的Cl- ,氯元素的化合价由 0 价降低为 -1 价。 即在这 个 反 应 中,氯 原 子 和 钠 原 子 之 间 发 生 了 电 子 的 得失 ,分别形成阴离子和阳离子,使元素的化合价发生了 变化。 2Na 0 +Cl 0 2 △ 2Na +1 失去 2×e - ,化合价 升高 ,被 氧化 ↓ Cl -1 得到 2×e - ,化合价 降低 ,被 还原 ↑ ②写出氢气与氯气反应的化学方程式:H2+Cl2 点燃 2HCl 。 分析:氢原子的原子结构示意图为 ○+1 ◝ 1 ◞ ,氯原子的 原子结构示意图为 ○+17 ◝ 2 ◞ ◝ 8 ◞ ◝ 7 ◞ 。氢原子和氯原子都具有 获得 1个电子形成稳定结构的倾向,均不易失去电子,两 者只能形成 共用电子对 ,且共用电子对偏向于吸引力稍强 的 氯 原子,偏离于 氢 原子。因此,氢元素的化合价由 0 价升高到+1价 ,被 氧化 ,氢气发生了 氧化 反应;氯元 素的化合价由 0价降低为-1价 ,被 还原 ,氯气发生了 还原 反应。即该反应生成的 HCl分子中的共用电子对发 生了 偏移 ,使元素的化合价发生了变化。 H2 0 +Cl 0 2 点燃 2H +1 化合价 升高 ,被 氧化 ↓ Cl -1 化合价 降低 ,被 还原 ↑ (2)结论。 ①反应中元素化合价升降的原因: 反应中元素化合价升降的原因是 电子的得失(或电子 对偏移)。电子的得失(或共用电子对偏移)的结果是形成 稳定结构。 ②氧化还原反应的本质: 有 电子转移(得失或偏移)的反应都是氧化还原反应。 元素的原子失去电子(或电子对偏离),物质发生 氧化反应 , 元素的原子得到电子(或电子对偏向),物质发生 还原反 应 。 微判断 1 (1)氧化还原反应中先发生氧化反应,后 发生还原反应。 ( ) (2)反应过程中所含元素的化合价降低的物质被氧化。 ( ) (3)有电子得失的反应一定是氧化还原反应。 ( ) (4)当反应中有一种元素被氧化时,一定有另一种元素 被还原。 ( ) (5)反应中不一定所有元素的化合价都发生变化。 ( ) 答案 (1)× (2)× (3)√ (4)× (5)√ 二、氧化还原反应与四种基本反应类型之间的 关系 根据已学习过的四种基本反应类型和氧化还原反应的 有关知识内容,完成下表。 序号 化学方程式 所属的 基本反 应类型 元素的化 合价有无 变化 是不是 氧化还 原反应 (1)2NO+O2 2NO2 化合 反应 有 是 (2)CO2+H2OH2CO3 化合 反应 无 不是 (3)NH4HCO3 △ NH3 ↑ +CO2↑+H2O 分解 反应 无 不是 (4) 2KClO3 MnO2 △ 2KCl+ 3O2↑ 分解 反应 有 是 (5) Fe+2HClFeCl2 + H2↑ 置换 反应 有 是 (6) Zn+CuSO4 ZnSO4 +Cu 置换 反应 有 是 (7) HCl+KOH KCl+ H2O 复分解 反应 无 不是 (8) BaCl2 + Na2SO4 BaSO4↓+2NaCl 复分解 反应 无 不是 微判断 2 (1)置换反应一定是氧化还原反应。 ( ) (2)化合反应不一定是氧化还原反应。 ( ) (3)有单质生成的反应一定是氧化还原反应。 ( ) 答案 (1)√ (2)√ (3)× 26

第一章物质及其变化 课堂 重难突破 氧化还原反应 提示汽车尾气中的CO和NO可以在催化剂作用下 发生反应,大部分转化为CO2和八2,反应的化学方程式为 重难归纳 2C0+2N0催化剂 2C02+N2。 1.氧化还原反应的特征和本质: (1)特征和本质。 典例剖析 特征元素化合价的升降一判断依据 下列反应中,一定发生电子转移的是()。 电子得失 本质电子转移 ANH,HCO,△NH,++CO,↑+H,0 电子对偏移 B.2KMnO,-A-KzMnO,+MnO:+O.+ (2)两者关系。 C.Ca(OH)2+COz-CaCO+H2O 元素原子 或电子对偏离元素化合价升高一物质被 失去电子 D.FeO+2HCI=H2O+FeCl2 答案B 氧化 解析发生电子转移的反应一定是氧化还原反应,判断 得到电子 元素原子 元素化合价降低→物质被 或电子对偏向 反应是不是氧化还原反应的关键是分析反应前后元素的化 还原 合价是否发生变化。B项,锰元素的化合价由十7价降低为 2.氧化还原反应中粒子间的转化关系。 十6价和十4价,氧元素的化合价由一2价升高为0价,发生 发生氧化反应 了电子转移,其他选项中元素的化合价均无变化。 阴离子失电子 失电子 失电子 方法归纳 低价阳离子 高价阳离子 得电子 得电子 得电子 (1)元素化合价的升降是氧化还原反应的外 发生还原反应 在特征,电子转移才是氧化还原反应的本质。 (2)电子转移无法直接判断,化合价的变化则比较直 3.氧化还原反应与四种基本反应类型之间的关系。 观,可直接进行判断,故元素化合价的变化可作为判断氧 化合 分解 化还原反应的“抓手”。得电子的原子对应元素的化合价 反应 反应 氧化还原反应 降低,失电子的原子对应元素的化合价升高。 置换反应 学以致用 复分解反应 (1)两个可能,即化合反应和分解反应可能是氧化还原 1.在反应MO,十4HC(浓)△MC,十2H,O+C,↑ 反应:两个一定,即所有的置换反应一定是氧化还原反应,所 中, 元素化合价升高, (填物质的化学式) 有的复分解反应一定不是氧化还原反应。 发生 (填“氧化”或“还原”)反应: (2)值得注意的是,四种基本反应类型不包括所有的反 元素化合价降低, (填物质的化学式)发生 应,例如:4HCI(浓)+MnO,△MnC,+C2个+2H,0不 (填“氧化”或“还原”)反应。 属于四种基本反应类型中的任何一种反应类型,但属于氧化 答案CI HCI氧化Mn MnO2还原 还原反应。 2.关于氮元素的变化如图所示。其中氮元素被还原的 ?思考发现 是 (填序号,下同),被氧化的是 ,既不被氧化又 不被还原的是 汽车尾气污染是由汽车排放的废气造成的环境污染 汽车尾气的主要污染物为一氧化碳、氮氧化物(NO和 尿素CONH2② NO2)、碳氢化合物、二氧化硫等。治理方法之一是在汽车排 动物 气管上加装“催化转换器”。 微生物、生物、工厂、闪电等 ① 3 N, NO:NO; 答案①④③② 请运用氧化还原反应原理写出将汽车尾气中NO和 解析分析氮元素在不同物质中的价态:在尿素、NH。 CO转化为无毒无害物质的化学方程式。 中氨元素显一3价,在NO5中氨元素显十5价,在NO2中 27
第一章 物质及其变化 课堂·重难突破 一 氧化还原反应 重难归纳 1.氧化还原反应的特征和本质: (1)特征和本质。 (2)两者关系。 元素原子 失去电子 或电子对偏离 →元素化合价升高 →物质被 氧化 元素原子 得到电子 或电子对偏向 →元素化合价降低 →物质被 还原 2.氧化还原反应中粒子间的转化关系。 3.氧化还原反应与四种基本反应类型之间的关系。 (1)两个可能,即化合反应和分解反应可能是氧化还原 反应;两个一定,即所有的置换反应一定是氧化还原反应,所 有的复分解反应一定不是氧化还原反应。 (2)值得注意的是,四种基本反应类型不包括所有的反 应,例如:4HCl(浓)+MnO2 △ MnCl2+Cl2↑+2H2O 不 属于四种基本反应类型中的任何一种反应类型,但属于氧化 还原反应。 汽车尾气污染是由汽车排放的废气造成的环境污染。 汽车尾气的主要污染物 为 一 氧 化 碳、氮 氧 化 物 (NO 和 NO2)、碳氢化合物、二氧化硫等。治理方法之一是在汽车排 气管上加装“催化转换器”。 请运用氧化还原反应原理写出将汽车尾气中 NO 和 CO转化为无毒无害物质的化学方程式。 提示 汽车尾气中的 CO 和 NO 可以在催化剂作用下 发生反应,大部分转化为 CO2 和 N2,反应的化学方程式为 2CO+2NO 催化剂 2CO2+N2。 典例剖析 下列反应中,一定发生电子转移的是( )。 A.NH4HCO3 △ NH3↑+CO2↑+H2O B.2KMnO4 △ K2MnO4+MnO2+O2↑ C.Ca(OH)2+CO2 CaCO3↓+H2O D.FeO+2HClH2O+FeCl2 答案 B 解析 发生电子转移的反应一定是氧化还原反应,判断 反应是不是氧化还原反应的关键是分析反应前后元素的化 合价是否发生变化。B项,锰元素的化合价由+7价降低为 +6价和+4价,氧元素的化合价由-2价升高为0价,发生 了电子转移,其他选项中元素的化合价均无变化。 (1)元素化合价的升降是氧化还原反应的外 在特征,电子转移才是氧化还原反应的本质。 (2)电子转移无法直接判断,化合价的变化则比较直 观,可直接进行判断,故元素化合价的变化可作为判断氧 化还原反应的“抓手”。得电子的原子对应元素的化合价 降低,失电子的原子对应元素的化合价升高。 学以致用 1.在反应 MnO2+4HCl(浓) △ MnCl2+2H2O+Cl2↑ 中, 元素化合价升高, (填物质的化学式) 发生 (填“氧化”或“还原”)反应; 元素化合价降低, (填物质的化学式)发生 (填“氧化”或“还原”)反应。 答案 Cl HCl 氧化 Mn MnO2 还原 2.关于氮元素的变化如图所示。其中氮元素被还原的 是 (填序号,下同),被氧化的是 ,既不被氧化又 不被还原的是 。 答案 ①④ ③ ② 解析 分析氮元素在不同物质中的价态:在尿素、NH3 中氮元素显-3价,在 NO- 3 中氮元素显+5价,在 NO- 2 中 27

化学 必修 第一册 配人教版 氨元素显十3价,N2中氨元素显0价,利用元素化合价降低 子转移情况,两者有何区别?在用双线桥法表示电子转移情 被还原,化合价升高被氧化解答本题。 况时,两个线桥上表示的电子总数有何关系? (2)下列用双线桥法表示反应的电子转移情况中,Mg 二氧化还原反应中电子转移的表示方法 共失去4e,O2得到4eˉ,因此反应中电子转移总数为8e, 对吗?为什么? 重难归纳 失去2×2e 1.双线桥法。 △ 2Mg+02 双线桥法表示反应前后同一元素原子的电子得失数目 或同一元素的化合价变化,反映了化学反应的本质及参加反 得到2×2e 应的各物质之间的氧化还原关系。 提示(1)双线桥法的线桥从反应物到产物,单线桥法 (1)书写的基本步骤: 的线桥只连反应物。双线桥法的线桥上下方需标明“得到” “失去”电子情况,而单线桥法中不霄标明电子“得到”“失 标价态 正确标出反应前后各元素的化合价 明确变价元素的化合价升降关系 去”。 表示氧化还原反应中电子转移、化合价升降、物质被氧 始于被还原的物质中的降价元素 化或被还原的关系时,用双线桥法较方便:只表示电子转移 条线 止于产物中的相应元素 方向和数目时,用单线桥法较方便。 连双线 (始于被氧化的物质中的升价元素 在用双线桥法表示电子转移情况时,两个线桥上电子总 条线 止于产物中的相应元素 数相等。 (2)错误。在氧化还原反应中,转移电子总数=得电子 注得失一标出“失去”或“得到”电子的总数 数=失电子数。在题述反应中,O2得到的电子即为Mg失 去的电子,也就是在反应中Mg把电子转移给O2,因此反应 (2)表示方法举例: 中电子转移总数为4e。 失去2×e,化合价升高,被氧化 2a+d,△2ad 典例剖析 碘缺乏病是机体因缺碘导致的疾病,缺碘会引起甲状腺 得到2Xeˉ,化合价降低,被还原 肿大,幼儿缺碘会影响生长发育,造成思维迟纯。 注意:上图得失电子使用了m×ne的形式进行表示, 食用碘盐可有效地消除碘缺乏病。碘盐是在食盐中加 其中m代表得失电子的原子个数,代表每个原子得失的 入适量的碘酸钾。检验食盐中是否加碘,可用如下反应: 电子数(当m或为1时要省略)。在用双线桥法表示电子 KIO3+5KI+3H2SO,—3K2SO4+3L2十3H20 得失时,也可只标电子转移情况,不写化合价升降及被氧化 (1)该反应中发生氧化反应和发生还原反应的物质分别 (还原)等内容。 是 (填化学式)。 2.单线桥法。 (2)分别用双线桥法和单线桥法表示出该反应中电子转 单线桥法表示反应物中元素原子之间的电子转移情况, 移的方向和数目。 即电子转移的方向和数目。 答案(1)K1 KIO3 (1)书写的基本步骤: (2)双线桥法 正确标出反应前后各元素的化合价 得到5e 标价态 明确变价元素的化合价升降关系 KIO2十5K+3H2SO,=3K2SO,十3I2十3H2O 始于被氧化物质中化合价 失去5Xe 升高的元素 单线桥法: 连单线 一条线 止于被还原物质中化合价 KIO十5K+3H2S0,—3KzSO,+3L2+3H2O 降低的元素 个 5e 解析反应中KIO3中碘元素化合价由十5价降低到0 注数目一标出转移电子的总数 价,得到电子被还原,发生还原反应:KI中碘元素由一1价 (2)表示方法举例: 升高到0价,失去电子被氧化,发生氧化反应。 2e 学以致用 Fe+2HC=FeCl2+H2↑ 注意:用单线桥法表示电子转移时,应标明电子转移的 1.下列氧化还原反应中,电子转移的方向和数目均正确 实际情况,箭头从失电子的元素原子指向得电子的元素原 的是( )。 子。在线桥上注明电子转移的数目时,只写数目,不标得失。 得到2Xe MnO ”思考发现 A.2H2 =2H20H02↑ (1)双线桥法和单线桥法均可表示氧化还原反应中的电 失去2×2e 28
化 学 必修 第一册 配人教版 氮元素显+3价,N2 中氮元素显0价,利用元素化合价降低 被还原,化合价升高被氧化解答本题。 二 氧化还原反应中电子转移的表示方法 重难归纳 1.双线桥法。 双线桥法表示反应前后同一元素原子的电子得失数目 或同一元素的化合价变化,反映了化学反应的本质及参加反 应的各物质之间的氧化还原关系。 (1)书写的基本步骤: 标价态 — 正确标出反应前后各元素的化合价 明确变价元素的化合价升降关系 ↓ 连双线 — 一条线 始于被还原的物质中的降价元素 止于产物中的相应元素 一条线 始于被氧化的物质中的升价元素 止于产物中的相应元素 ↓ 注得失 —标出“失去”或“得到”电子的总数 (2)表示方法举例: 2Na 0 +Cl2 0 △ 2Na +1 失去2×e - ,化合价升高,被氧化 ↓ Cl -1 得到2×e - ,化合价降低,被还原 ↑ 注意:上图得失电子使用了m×ne- 的形式进行表示, 其中m 代表得失电子的原子个数,n 代表每个原子得失的 电子数(当m 或n为1时要省略)。在用双线桥法表示电子 得失时,也可只标电子转移情况,不写化合价升降及被氧化 (还原)等内容。 2.单线桥法。 单线桥法表示反应物中元素原子之间的电子转移情况, 即电子转移的方向和数目。 (1)书写的基本步骤: 标价态 — 正确标出反应前后各元素的化合价 明确变价元素的化合价升降关系 ↓ 连单线 —一条线 始于被氧化物质中化合价 升高的元素 止于被还原物质中化合价 降低的元素 ↓ 注数目 —标出转移电子的总数 (2)表示方法举例: Fe+2H 2e- ↓ ClFeCl2+H2↑ 注意:用单线桥法表示电子转移时,应标明电子转移的 实际情况,箭头从失电子的元素原子指向得电子的元素原 子。在线桥上注明电子转移的数目时,只写数目,不标得失。 (1)双线桥法和单线桥法均可表示氧化还原反应中的电 子转移情况,两者有何区别? 在用双线桥法表示电子转移情 况时,两个线桥上表示的电子总数有何关系? (2)下列用双线桥法表示反应的电子转移情况中,Mg 共失去4e- ,O2 得到4e- ,因此反应中电子转移总数为8e- , 对吗? 为什么? 2Mg+O2 △ 2M 失去2×2e- ↓ gO 得到2×2e- ↑ 提示 (1)双线桥法的线桥从反应物到产物,单线桥法 的线桥只连反应物。双线桥法的线桥上下方需标明“得到” “失去”电子情况,而单线桥法中不需标明电子“得到”“失 去”。 表示氧化还原反应中电子转移、化合价升降、物质被氧 化或被还原的关系时,用双线桥法较方便;只表示电子转移 方向和数目时,用单线桥法较方便。 在用双线桥法表示电子转移情况时,两个线桥上电子总 数相等。 (2)错误。在氧化还原反应中,转移电子总数=得电子 数=失电子数。在题述反应中,O2 得到的电子即为 Mg失 去的电子,也就是在反应中 Mg把电子转移给 O2,因此反应 中电子转移总数为4e- 。 典例剖析 碘缺乏病是机体因缺碘导致的疾病,缺碘会引起甲状腺 肿大,幼儿缺碘会影响生长发育,造成思维迟钝。 食用碘盐可有效地消除碘缺乏病。碘盐是在食盐中加 入适量的碘酸钾。检验食盐中是否加碘,可用如下反应: KIO3+5KI+3H2SO4 3K2SO4+3I2+3H2O (1)该反应中发生氧化反应和发生还原反应的物质分别 是 、 (填化学式)。 (2)分别用双线桥法和单线桥法表示出该反应中电子转 移的方向和数目。 答案 (1)KI KIO3 (2)双线桥法: KIO3+5KI+3H2SO43K2SO4+3I 得到5e - ↓ 失去5×e - ↑ 2+3H2O 单线桥法: KIO3+5KI 5e - ↑ +3H2SO43K2SO4+3I2+3H2O 解析 反应中 KIO3 中碘元素化合价由+5价降低到0 价,得到电子被还原,发生还原反应;KI中碘元素由-1价 升高到0价,失去电子被氧化,发生氧化反应。 学以致用 1.下列氧化还原反应中,电子转移的方向和数目均正确 的是( )。 A.2H2O2 MnO2 2H2O 得到2×e- ↓ +O 失去2×2e- ↑ 2↑ 28

第一章物质及其变化 失去2×2e 失去4e B.2C十02 =2CuO D.CHO 点燃 得到2×2e 得到2e 失去2X2e 答案B C.2Cu04c高温 CCO2个 2.写出铝粉与盐酸反应的化学方程式并用单线桥法标 出电子转移的方向和数目。 得到2×2e 6e 答案2A+6HC1—2AICL,+3H2↑ 随堂训练 L.判断一个反应是不是氧化还原反应的标准是( 解析被还原的物质就是反应过程中得到电子、所含元素 A是不是有氧元素参加反应 化合价降低的物质。反应中S元素化合价由0价降低到 B.是不是置换反应 一2价,N元素化合价由十5价降低到0价,则KNO3和S C.同一元素的化合价在反应前后是不是发生变化 在反应中被还原。 D.是不是化合反应或分解反应 5.下列电子转移的表示方法中正确的是()。 答案C 得到2×3e,化合价降低,被氧化 解析氧化还原反应的特征是存在元素化合价的变化。 AFe,0+3C0△ 2Fe+3C02 2.古诗词是古人为我们留下的宝贵精神财富。下列诗句中 不涉及氧化还原反应的是()。 失去3×2e,化合价升高,被还原 A.野火烧不尽,春风吹又生 +2×3e,化合价降低,被还原 B.春蚕到死丝方尽,蜡炬成灰泪始干 aFe,0,+3C0△2ic+3C0, C.粉身碎骨浑不怕,要留清白在人间 一3×2e,化合价升高,被氧化 D.爆竹声中一岁除,春风送暖入屠苏 失去3×2e,化合价降低,被还原 答案C CFe,0,+3C0△2fe+3C0 解析A、B、D三项中均有可燃物的燃烧,燃烧反应均是 氧化还原反应:C项中涉及反应CaCO3 熾提Ca0十 得到2×3e,化合价升高,被氧化 得到2×3e,化合价降低,被还原 CO2个,该反应不是氧化还原反应。 3.下列基本反应类型中一定发生电子转移的是( )。 D.Fe0,+3CO△ =2Fe+3C02 A化合反应 失去3×2e,化合价升高,被氧化 B.分解反应 答案D C.置换反应 6.野外焊接铁轨常常采用铝热反应。 D.复分解反应 答案C 解析置换反应一定属于氧化还原反应,一定发生电子 转移。 4.我国古代“四大发明”在人类发展史上起到了非常重要的 作用。 已知铝热反应的原理为Fe,O,十2A1高温Al,O,十2Fe。 (1) 元素的化合价升高,则该元素的原子 电子,被 (填“氧化”或“还原”):而 元 素的化合价降低,则该元素的原子 电子,被 (填“氧化”或“还原”)。 黑火药爆炸的反应为S十2KNO3+3C 点燃K,S十 (2)该反应中FezO3发生了 反应,AI发生了 3CO2↑十N2↑。在该反应中,被还原的物质是( )。 反应。 A.KNO B.C 答案(1)Al失去氧化Fe得到还原(2)还原 C.KNO3和S D.KNO3和C 氧化 答案C 29
第一章 物质及其变化 B.2Cu+O2 △ 2C 失去2×2e- ↓ uO 得到2×2e- ↑ C.2CuO+C 高温 2C 失去2×2e- ↓ u+C 得到2×2e- ↑ O2↑ D.C+O2 点燃 C 失去4e- ↓ O 得到2e- ↑ 2 答案 B 2.写出铝粉与盐酸反应的化学方程式并用单线桥法标 出电子转移的方向和数目。 答案 2Al+6H 6e- ↓ Cl2AlCl3+3H2↑ 随堂训练 1.判断一个反应是不是氧化还原反应的标准是( )。 A.是不是有氧元素参加反应 B.是不是置换反应 C.同一元素的化合价在反应前后是不是发生变化 D.是不是化合反应或分解反应 答案 C 解析 氧化还原反应的特征是存在元素化合价的变化。 2.古诗词是古人为我们留下的宝贵精神财富。下列诗句中 不涉及氧化还原反应的是( )。 A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干 C.粉身碎骨浑不怕,要留清白在人间 D.爆竹声中一岁除,春风送暖入屠苏 答案 C 解析 A、B、D三项中均有可燃物的燃烧,燃烧反应均是 氧化 还 原 反 应;C 项 中 涉 及 反 应 CaCO3 煅烧 CaO+ CO2↑,该反应不是氧化还原反应。 3.下列基本反应类型中一定发生电子转移的是( )。 A.化合反应 B.分解反应 C.置换反应 D.复分解反应 答案 C 解析 置换反应一定属于氧化还原反应,一定发生电子 转移。 4.我国古代“四大发明”在人类发展史上起到了非常重要的 作用。 黑火 药 爆 炸 的 反 应 为 S+2KNO3 +3C 点燃 K2S+ 3CO2↑+N2↑。在该反应中,被还原的物质是( )。 A.KNO3 B.C C.KNO3 和S D.KNO3 和C 答案 C 解析 被还原的物质就是反应过程中得到电子、所含元素 化合价降低的物质。反应中S元素化合价由0价降低到 -2价,N元素化合价由+5价降低到0价,则 KNO3 和S 在反应中被还原。 5.下列电子转移的表示方法中正确的是( )。 A.Fe2O3+3CO △ 2Fe 得到2×3e-,化合价降低,被氧化 ↓ +3C 失去3×2e-,化合价升高,被还原 ↑ O2 B.Fe2O3+3CO △ 2F +2×3e-,化合价降低,被还原 ↓ e+3C -3×2e-,化合价升高,被氧化 ↑ O2 C.Fe2O3+3CO △ 2F 失去3×2e-,化合价降低,被还原 ↓ e+3C 得到2×3e-,化合价升高,被氧化 ↑ O2 D.Fe2O3+3CO △ 2F 得到2×3e-,化合价降低,被还原 ↓ e+3C 失去3×2e-,化合价升高,被氧化 ↑ O2 答案 D 6.野外焊接铁轨常常采用铝热反应。 已知铝热反应的原理为Fe2O3+2Al 高温 Al2O3+2Fe。 (1) 元素的化合价升高,则该元素的原子 电子,被 (填“氧化”或“还原”);而 元 素的化合价降低,则该元素的原子 电子,被 (填“氧化”或“还原”)。 (2)该反应中Fe2O3 发生了 反应,Al发生了 反应。 答案 (1)Al 失去 氧化 Fe 得到 还原 (2)还原 氧化 29

化学 必修 第一册 配人教版 课后·训练提升 合格考·基础巩固 C.3NO2+H2O=2HNO+NO D.NaOH+HCl—NaCl+HO 1.下列有关氧化还原反应实质的说法中正确的是( 答案C A.是否有电子转移 解析A,B、D三项涉及的反应中均不存在元素化合价的 B.是否有元素化合价的变化 变化,均不是氧化还原反应;C项中反应是氧化还原反应。 C.是否有氧元素的参加 5.下列反应中(未配平)肯定不正确的是()。 D.是否有原子的重新组合 A.S+KOH-K2SO+K2S+H2O 答案A B.FeO+HNO3-Fe(NO3)3+H2O 解析氧化还原反应的实质是有电子转移(包括电子得失 C.Cu2O+H2SO-CuSO+Cu+H2O 和电子对偏移),而外部特征是有元素化合价发生变化。 D.NH,NO3→N2O+H2O 只要有元素化合价升降的反应就是氧化还原反应,与是否 答案B 有氧元素参加无关。 解析氧化还原反应中必须同时存在元素化合价的升高 2.已知某两种物质在一定条件下能发生化学反应,其反应的 与降低,B项中的反应只有元素化合价的升高,无元素化 微观示意图如下,则下列说法不正确的是( 合价的降低,因此一定不正确。 O0+(○0+00+○0 6.下列各氧化还原反应的化学方程式表示的电子转移情况 ●○ 正确的是( )。 (说明:一种小球代表一种元素的原子) 失去3×2e A图中的反应物都是化合物 MnO2 B.该反应属于置换反应 =2KC+302↑ △ C.该反应属于氧化还原反应 得到6e D.该反应一定符合质量守恒定律 失去4×e 答案A BMn0,+HHC1(浓)△MnC2+d2+2H,0 解析该反应是一种单质和一种化合物反应生成另一种 得到2e 单质和另一种化合物的置换反应,一定是氧化还原反应, 失去2×e 所有化学反应都符合质量守恒定律。 3.氧化还原反应与四种基本反应类型的关系如图所示,则下列 C.Cl,+2NaOH-NaCHNaCIO+H2O 化学反应属于阴影部分的是( )。 得到2×e 失去5×e 化合反应 分解反应 D.KCIO,+6HC△KCH3C2↑+3H,0 氧化还原反应 置换反应 得到5e 答案D (复分解反应 解析A项,双线桥上转移电子数标注不对,与“3O2”对 应的应该标注为“失去6X2e-”,与“2KCI”对应的应该标 A.Cl2+2KBr=Br2+2KCI 注为“得到2X6e-”,错误:B项,生成1个Cl2应转移2个 B.2NaHCO,-A-Na:CO+H:O+CO:+ e,有2个HCl未失去电子,错误;C项,一部分Cl2得电 C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 子,一部分C2失电子,上下线桥上应分别标注为“失去 D.2Na202+2C02—2NazC02十02 e”和“得到e-”,错误。 答案D 7.水是人体的重要组成部分,是人体中含量最多的物质。 解析图中阴影部分为氧化还原反应,但不属于四种基本 “四种基本反应类型与氧化还原反应的关系”也可用下图 反应类型,A项中反应为置换反应:B项中反应是分解反 表示。 应,且不属于氧化还原反应:C项中反应是化合反应:D项 中反应是氧化还原反应,但不属于四种基本反应类型。 非氧化还原反应 4.下列反应中有一个反应与其他三个反应不同,则该反应 是()。 A.SiO2+2NaOH=NazSiO3+H2O 氧化还原反应号 B.S0,+H20—H2S0, 30
化 学 必修 第一册 配人教版 课后·训练提升 合格考 基础巩固 1.下列有关氧化还原反应实质的说法中正确的是( )。 A.是否有电子转移 B.是否有元素化合价的变化 C.是否有氧元素的参加 D.是否有原子的重新组合 答案 A 解析 氧化还原反应的实质是有电子转移(包括电子得失 和电子对偏移),而外部特征是有元素化合价发生变化。 只要有元素化合价升降的反应就是氧化还原反应,与是否 有氧元素参加无关。 2.已知某两种物质在一定条件下能发生化学反应,其反应的 微观示意图如下,则下列说法不正确的是( )。 (说明:一种小球代表一种元素的原子) A.图中的反应物都是化合物 B.该反应属于置换反应 C.该反应属于氧化还原反应 D.该反应一定符合质量守恒定律 答案 A 解析 该反应是一种单质和一种化合物反应生成另一种 单质和另一种化合物的置换反应,一定是氧化还原反应, 所有化学反应都符合质量守恒定律。 3.氧化还原反应与四种基本反应类型的关系如图所示,则下列 化学反应属于阴影部分的是( )。 A.Cl2+2KBrBr2+2KCl B.2NaHCO3 △ Na2CO3+H2O+CO2↑ C.4Fe(OH)2+O2+2H2O4Fe(OH)3 D.2Na2O2+2CO2 2Na2CO3+O2 答案 D 解析 图中阴影部分为氧化还原反应,但不属于四种基本 反应类型,A项中反应为置换反应;B项中反应是分解反 应,且不属于氧化还原反应;C项中反应是化合反应;D项 中反应是氧化还原反应,但不属于四种基本反应类型。 4.下列反应中有一个反应与其他三个反应不同,则该反应 是( )。 A.SiO2+2NaOHNa2SiO3+H2O B.SO3+H2OH2SO4 C.3NO2+H2O2HNO3+NO D.NaOH+HClNaCl+H2O 答案 C 解析 A、B、D三项涉及的反应中均不存在元素化合价的 变化,均不是氧化还原反应;C项中反应是氧化还原反应。 5.下列反应中(未配平)肯定不正确的是( )。 A.S+KOH →K2SO3+K2S+H2O B.FeO+HNO3 →Fe(NO3)3+H2O C.Cu2O+H2SO4 →CuSO4+Cu+H2O D.NH4NO3 →N2O+H2O 答案 B 解析 氧化还原反应中必须同时存在元素化合价的升高 与降低,B项中的反应只有元素化合价的升高,无元素化 合价的降低,因此一定不正确。 6.下列各氧化还原反应的化学方程式表示的电子转移情况 正确的是( )。 A.2KClO3 MnO2 △ 2KC 得到6e- ↑ l+3O 失去3×2e- ↓ 2↑ B.MnO2+4HCl(浓) △ M 得到2e- ↑ nCl2+C 失去4×e- ↓ l2↑+2H2O C.Cl2+2NaOHNaC 得到2×e- ↑ l+NaC 失去2×e- ↓ lO+H2O D.KClO3+6HCl △ KCl+3C 失去5×e- ↓ 得到5e- ↑ l2↑+3H2O 答案 D 解析 A项,双线桥上转移电子数标注不对,与“3O2”对 应的应该标注为“失去6×2e- ”,与“2KCl”对应的应该标 注为“得到2×6e- ”,错误;B项,生成1个Cl2 应转移2个 e- ,有2个 HCl未失去电子,错误;C项,一部分Cl2 得电 子,一部分Cl2 失电子,上下线桥上应分别标注为“失去 e- ”和“得到e- ”,错误。 7.水是人体的重要组成部分,是人体中含量最多的物质。 “四种基本反应类型与氧化还原反应的关系”也可用下图 表示。 30