
显然若以△G对n作图,得到的应是一条直线,直线的斜率 为电对M+/M的电极电势。对任何两个氧化态物种(Mm+M+)也 可得到类似的直线(△G对(m一n)作图,直线的斜率为电对Mm M+的电极电势),将这些氧化态物种的直线组合起来,即得到 自由能一氧化态图。 在构成自由焓氧化态图时可以分为两步,首先是算出元素由 单质转化成某一氧化态的自由焓变值。 如求 Mn→MnO,的△G。 求△G有两种方法:一种是从热力学数据出发, Mn++2H,O=MnO,+4H++4e △G/kJmol-10-237-464.40 0 △G=[△GMnO2)+4△G(H+)+4△G(e)] -[△GMn)+2△G(HO)] =[-464.5+4×0+4×0]-[0×2×(-237)] -9.6 kJmol- =0.1eV leV=96.485 kJmol 另一种是从电极电势出发:Mn+2H,O=MnO,+4H++4e 若已知o(MnO,Mn),则可由△G=nFo求出△G
显然若以△Gθ对n作图,得到的应是一条直线,直线的斜率 为电对Mn+/M)的电极电势。对任何两个氧化态物种(Mm+/Mn+)也 可得到类似的直线(△Gθ对(m-n)作图,直线的斜率为电对Mm+ /Mn+的电极电势),将这些氧化态物种的直线组合起来,即得到 自由能-氧化态图。 在构成自由焓氧化态图时可以分为两步,首先是算出元素由 单质转化成某一氧化态的自由焓变值。 如求 Mn MnO2的△Gθ 。 求△Gθ有两种方法:一种是从热力学数据出发, Mn+2H2O=MnO2+4H++4e △fGθ / kJ·mol-1 0 -237 -464.4 0 0 △Gθ=[△fGθ (MnO2 )+4△fGθ (H+)+4△fGθ (e)] -[△fGθ (Mn)+2△fGθ (H2O)] =[-464.5+4×0+4×0]-[0×2×(-237)] =9.6 kJ·mol-1 =0.1eV 1eV=96.485 kJ·mol-1 另一种是从电极电势出发:Mn+2H2O=MnO2+4H++4e 若已知φ θ (MnO2 /Mn) ,则可由△Gθ=nFφ θ求出△Gθ

另一种是从电极电势出发:Mn+2H,O→MnO,+4H++4e 若已知o(MnO,Mn),则可由△G=nFo求出△G。 值得指出的是:电池半反应的自由焓变计算公式为△G= nFo,它是相对于还原半反应 氧化态+ne一还原态 而来。但一年级学过,电极电势与电极反应方程式的书写无关, 即电极电势与反应书写的方向无关。如 Na+(aq)+eNa(s),0-2.71V,AG0=-nFoo Na(s)-eNa+(aq),o=-2.71V,△Ga=nFφ 但反应的自由焓变却与反应的方向有关,对于正反应是 △G,逆反应是一△G。这样一来,对还原半反应△G=一 nFo,那么对于氧化半反应△G=nFo。 φ(MnO,Mn)在表中查不到,可通过电势图求算:
另一种是从电极电势出发:Mn+2H2O MnO2+4H++4e 若已知φ θ (MnO2 /Mn) ,则可由△Gθ=nFφ θ求出△Gθ 。 值得指出的是:电池半反应的自由焓变计算公式为△Gθ= nFφ θ ,它是相对于还原半反应 氧化态+ne 还原态 而来。但一年级学过,电极电势与电极反应方程式的书写无关, 即电极电势与反应书写的方向无关。如 Na+(aq)+e Na(s), φ θ=-2.71V, △Gθ=-nFφ θ Na(s)-e Na+(aq), φ θ=-2.71V, △Gθ=nFφ θ 但反应的自由焓变却与反应的方向有关,对于正反应是 △Gθ ,逆反应是-△Gθ 。这样一来,对还原半反应 △Gθ=- nFφ θ ,那么对于氧化半反应△Gθ=nFφ θ 。 φ θ (MnO2 /Mn)在表中查不到,可通过电势图求算:
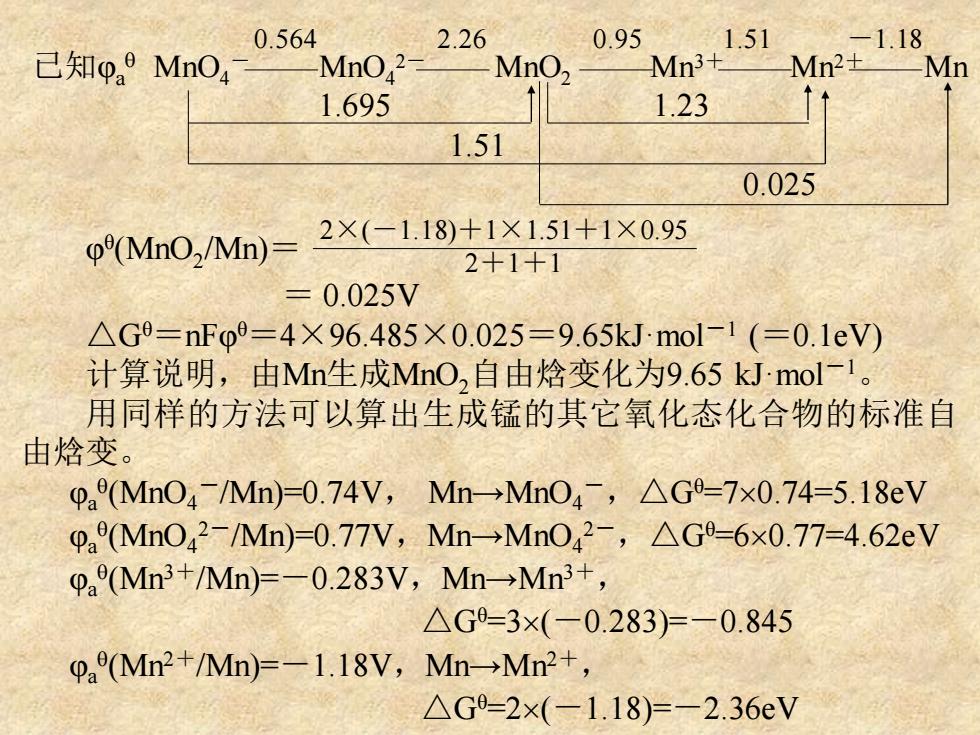
0.564 2.26 0.95 .51 己知pa9MnO, Mn042 MnO, Mn3+ 1.695 1.23 1.51 0.025 φ(MnO2/Mn)= 2×(-1.18)+1×1.51+1×0.95 2+1+1 =0.025V △G9=nFo9=4×96.485×0.025=9.65 kJmol-1(=0.1eV) 计算说明,由Mn生成MnO,自由焓变化为9.65 kJmol-1。 用同样的方法可以算出生成锰的其它氧化态化合物的标准自 由焓变。 paMn04Mn)=0.74V,Mn→MnO4-,△G-7×0.74=5.18eV pa(Mn042/Mn)-0.77V,Mn→MnO42-,△G-6x0.77=4.62eV 0(Mn3+/Mn)=-0.283V,Mn-Mn3+, △G=3×(-0.283)=-0.845 (Mn2+/Mn)=-1.18V,Mn-Mn2+, △G-2×(-1.18)=-2.36eV
已知φa MnO4 - MnO4 2- MnO2 Mn3+ Mn2+ Mn 1.695 1.23 1.51 0.025 0.564 2.26 0.95 1.51 -1.18 φ θ (MnO2 /Mn)= = 0.025V △Gθ=nFφ θ=4×96.485×0.025=9.65kJ·mol-1 (=0.1eV) 计算说明,由Mn生成MnO2自由焓变化为9.65 kJ·mol-1 。 用同样的方法可以算出生成锰的其它氧化态化合物的标准自 由焓变。 φa (MnO4 -/Mn)=0.74V, Mn→MnO4 -,△Gθ=70.74=5.18eV φa (MnO4 2-/Mn)=0.77V,Mn→MnO4 2-,△Gθ=60.77=4.62eV φa (Mn3+/Mn)=-0.283V,Mn→Mn3+ , △Gθ=3(-0.283)=-0.845 φa (Mn2+/Mn)=-1.18V,Mn→Mn2+ , △Gθ=2(-1.18)=-2.36eV 2×(-1.18)+1×1.51+1×0.95 2+1+1

以△G对n作图得到如右图所 HMnO 示的Mn元素在酸性介质的自由能 +5 H2MnO 氧化态图。 △G9 具体的作法是:以△G为纵坐 ev 5.18 标,以氧化态为横坐标绘出各点, +3 HMnO3 将各点连接成线,即得到自由焓 4.62 氧化态图。 图上各点为由单质生成该氧化 态物种的标准自由焓值,点间的连 Mn 线的斜率为对应氧化态个体所组成 0845 -2.36 的电对的电极电势[因为△G= nF09,F=96.485kJV-1mol-1=1 eV,△G对n作图是一条直线,直 线的斜率是E(若以eV为能量单 位)】 +1 +2 +3+4 +5+6+7 氧化数 由图上较高位置移到较低位置,表示自由焓减小,即过程的 △G值是负值;相反由较低位置移到较高位置,过程的△G为正值 沿一条线从左到右移是由氧化来完成,从右到左则是还原过程
以△Gθ对n作图得到如右图所 示的Mn元素在酸性介质的自由能 -氧化态图。 具体的作法是:以△Gθ为纵坐 标,以氧化态为横坐标绘出各点, 将各点连接成线,即得到自由焓- 氧化态图。 图上各点为由单质生成该氧化 态物种的标准自由焓值,点间的连 线的斜率为对应氧化态个体所组成 的电对的电极电势[因为△Gθ= nFφ θ , F=96.485 kJ·V-1·mol-1=1 eV,△Gθ对n作图是一条直线,直 线的斜率是E θ (若以eV为能量单 位)]。 ΔGθ eV -2.36 -0.845 0.1 4.62 5.18 由图上较高位置移到较低位置,表示自由焓减小,即过程的 △Gθ值是负值;相反由较低位置移到较高位置,过程的△Gθ为正值。 沿一条线从左到右移是由氧化来完成,从右到左则是还原过程
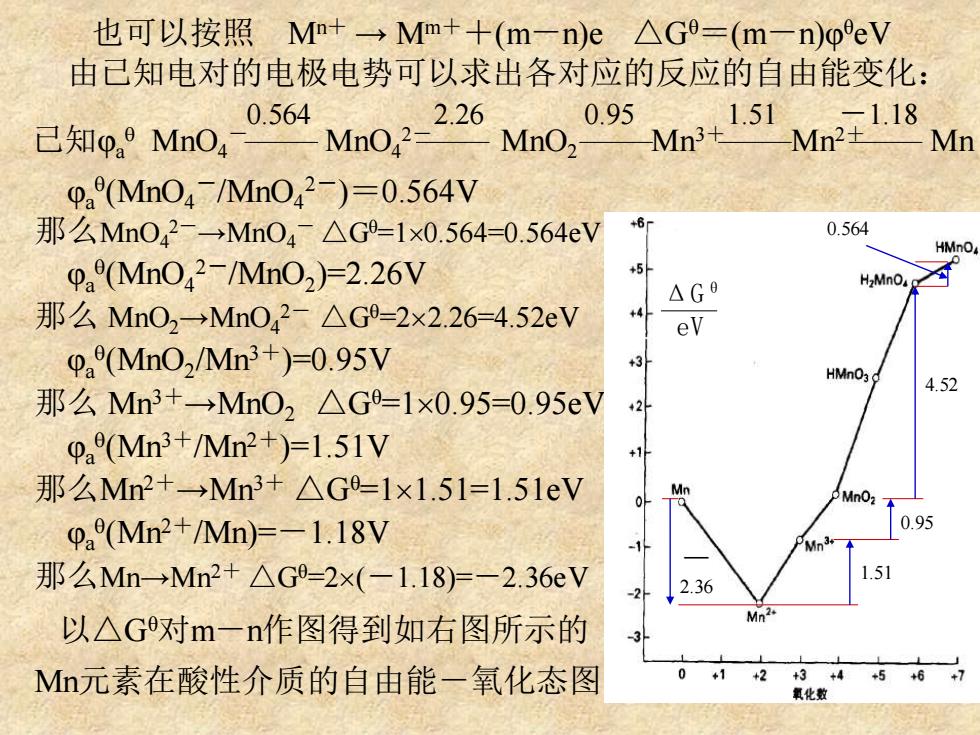
也可以按照M+→Mm++(m-n)e△G=(m一n)oeV 由己知电对的电极电势可以求出各对应的反应的自由能变化: 0.564 2.26 .95 已知pa9MnO4 Mno Mno, Mn 0a(Mn04Mn042-)=0.564V 那么Mn042-→Mn04△G9-1×0.564=0.564eV 0.564 HMno pa(Mn042-/Mn02)=2.26V 5 △G6 H2MnO 那么MnO2→MnO42-△G9=2×2.26-4.52eV +4 eV 0a(MnO2/Mn3+)=0.95V 3 HMn03 4.52 那么Mn3+→Mn02△G-1×0.95=0.95eV 0aMn3+/Mn2+)=1.51V 那么Mn2+→Mn3+△G-1x1.51=1.51eV pa(Mn2+/Mn)=-1.18V 那么Mn→Mn2+△G9-2x(-1.18)=-2.36V 2.36 以△G对m一n作图得到如右图所示的 Mn元素在酸性介质的自由能一氧化态图 +3
也可以按照 Mn+ → Mm++(m-n)e △Gθ=(m-n)φ θeV 由已知电对的电极电势可以求出各对应的反应的自由能变化: φa (MnO4 -/MnO4 2-)=0.564V 那么MnO4 2-→MnO4 - △Gθ=10.564=0.564eV φa (MnO4 2-/MnO2 )=2.26V 那么 MnO2→MnO4 2- △Gθ=22.26=4.52eV φa (MnO2 /Mn3+)=0.95V 那么 Mn3+→MnO2 △Gθ=10.95=0.95eV φa (Mn3+/Mn2+)=1.51V 那么Mn2+→Mn3+ △Gθ=11.51=1.51eV φa (Mn2+/Mn)=-1.18V 那么Mn→Mn2+ △Gθ=2(-1.18)=-2.36eV 以△Gθ对m-n作图得到如右图所示的 Mn元素在酸性介质的自由能-氧化态图。 ΔGθ eV 已知φa MnO4 - MnO4 2- MnO2 Mn3+ Mn2+ Mn 0.564 2.26 0.95 1.51 -1.18 -2.36 1.51 0.95 4.52 0.564