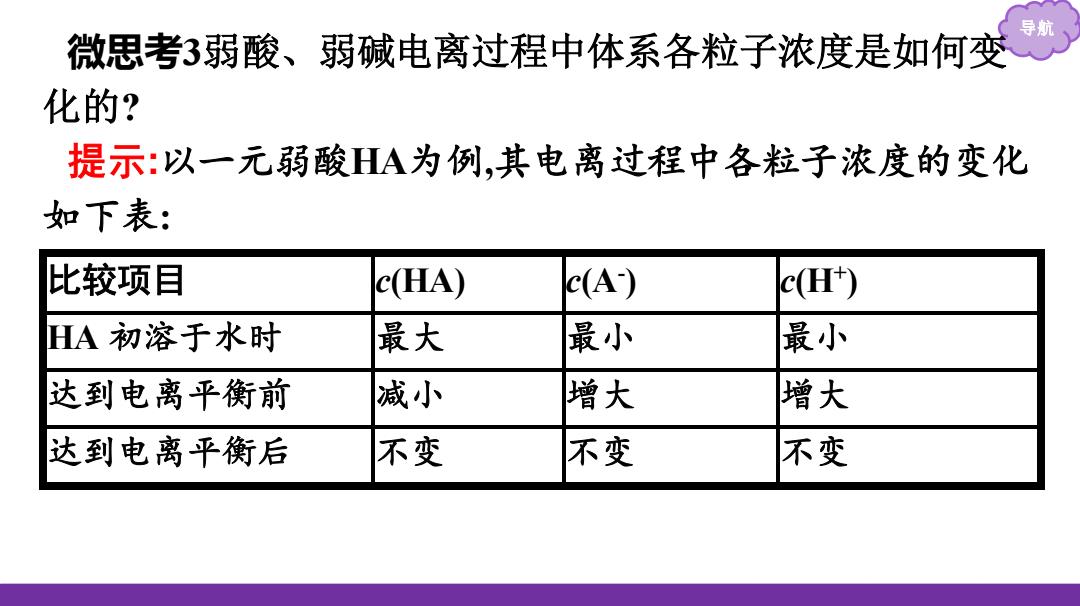
微思考3弱酸、弱碱电离过程中体系各粒子浓度是如何变 化的? 提示:以一元弱酸HA为例,其电离过程中各粒子浓度的变化 如下表: 比较项目 c(HA) c(A) c(H) HA初溶于水时 最大 最小 最小 达到电离平衡前 减小 增大 增大 达到电离平衡后 不变 不变 不变
导航 微思考3弱酸、弱碱电离过程中体系各粒子浓度是如何变 化的? 提示:以一元弱酸HA为例,其电离过程中各粒子浓度的变化 如下表: 比较项目 c(HA) c(A- ) c(H+ ) HA 初溶于水时 最大 最小 最小 达到电离平衡前 减小 增大 增大 达到电离平衡后 不变 不变 不变

导 三、电离平衡常数 1.含义:对一元弱酸或一元弱碱来说,溶液中弱电解质电离所 生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之 比是一个常数,这个常数叫做 常数,简称 常数。通常用K、K分别表示弱酸、弱碱的电离平衡常数。 2.表示方法:对于CH3COOH=CH3CO0+HH Ka=
导航 三、电离平衡常数 1.含义:对一元弱酸或一元弱碱来说,溶液中弱电解质电离所 生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之 比是一个常数,这个常数叫做 电离平衡 常数,简称 电离 常数。通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。 2.表示方法:对于 CH3COOH CH3COO- +H+ Ka= 𝒄(𝐂𝐇𝟑 𝑪𝑶𝐎 - )·𝒄(𝐇+) 𝒄(𝐂𝐇𝟑 𝑪𝑶𝑶𝑯)

导航 3.K的意义:它能表示弱电解质的电离能力。 (1)温度一定时,K越 ,弱电解质的电离程度越大;越 ,弱电解质的电离程度越小。 (2)多元弱酸每步电离都有电离常数,分别表示为Ka1、Ka2 Ka3等,这些常数间的关系为
导航 3.K的意义:它能表示弱电解质的电离能力。 (1)温度一定时,K越 大 ,弱电解质的电离程度越大;K越 小 ,弱电解质的电离程度越小。 (2)多元弱酸每步电离都有电离常数,分别表示为𝑲𝐚𝟏 、𝑲𝐚𝟐 、 𝑲𝐚𝟑 等,这些常数间的关系为 𝑲𝐚𝟏 > 𝑲𝐚𝟐 > 𝑲𝐚𝟑

预习检测 导 1.判断正误,正确的画“V,错误的画“X”。 (1)有两种电解质A、B,若A的溶液导电能力强于B的,则A是 强电解质,B是弱电解质。(×) (2)比较同一温度下不同弱酸的电离常数的大小,可以知道其 酸性的相对强弱。(√) 3)稀释氨水,一水合氨的电离程度增大,所以相同温度下,0.1 moL1氨水中一水合氨的Kh大于0.2moL1氨水中一水合氨 的Kb。(X)
导航 1.判断正误,正确的画“√”,错误的画“×” 。 (1)有两种电解质A、B,若A的溶液导电能力强于B的,则A是 强电解质,B是弱电解质。( ) (2)比较同一温度下不同弱酸的电离常数的大小,可以知道其 酸性的相对强弱。( ) (3)稀释氨水,一水合氨的电离程度增大,所以相同温度下,0.1 mol·L-1氨水中一水合氨的Kb大于0.2 mol·L-1氨水中一水合氨 的Kb 。( ) × √ 预 习 检 测 ×

导航、 (4)CH.COOH溶液中加入少量NaOH溶液,CH:COOH的电离 平衡右移,K变大。(×)
导航 (4)CH3COOH溶液中加入少量NaOH溶液,CH3COOH的电离 平衡右移,Ka变大。( × )