
§4.4化学势 1.化学势的定义 在多组分系统中,每个热力学函数的变量就 不止两个,还与组成系统各物的物质的量有关, 所以要在基本公式中增加组成这个变量 ()吉布斯自由能 设系统中有1,2,3,.,k个组分 所含的量分别为n1,n2,nk G=GT,p,n1,n23.,nk)
§4.4 化 学 势 1. 化学势的定义 在多组分系统中,每个热力学函数的变量就 不止两个,还与组成系统各物的物质的量有关, 所以要在基本公式中增加组成这个变量 (1)吉布斯自由能 设系统中有 1,2,3, , k 个组分 所含的量分别为 1 2 , , , n n nk 1 2 ( , , , , , ) G G T p n n nk =

1.化学势的定义 G=G(T,p,n1,n2,.,nk) 其全微分为 dG=( -1 8G 定义化学势 def JT,P,(c≠B) 第一个基本公式就可表示为: dG=-SdT+p+∑hdne
1. 化学势的定义 c B B k , , , , (c B) B B 1 B d ( ) d ( ) d ( ) d p n T n T p n G G G G T p n T p n = = + + 其全微分为 定义化学势 B , , (c B) def ( )T p nc B G n 第一个基本公式就可表示为: B B B dG d d d = − + + S T V p n 1 2 ( , , , , , ) G G T p n n n = k

dH =dG+d(TS)=-SdT+Vdp+updn +TdS+SdT =TS+V+∑4gnB B 多组分系统的热力学基本公式应表示为: dU=TdS-pdV+∑4edne dH=TdS+Vp+∑4dne dA=-SdT-pdV+∑Lrdnn dG=-SdT+p+∑dn
dH dG d TS = + ( ) B B B = − + + + + SdT Vdp dn TdS SdT B B B = + + TdS Vdp dn 多组分系统的热力学基本公式应表示为: B B B d d d d H T S V p n = + + B B B d d d d A S T p V n = − − + B B B d d d d G S T V p n = − + + B B B d d d d U T S p V n = − +

相应的化学势定义式为: def aH )T,p,nc(c+B) JS,p,ne(c≠B) 6A aU )s,V,necB) 保持热力学函数的特征变量和除B以外其它组 分不变,某热力学函数随物质的量的变化率称 为化学势
保持热力学函数的特征变量和除B以外其它组 分不变,某热力学函数随物质的量 的变化率称 为化学势。 B n 相应的化学势定义式为: B , , (c B) def ( )T p nc B G n , , (c B) ( )T V nc B A n = , , (c B) ( ) c S V n B U n = , , (c B) ( )S p nc B H n =
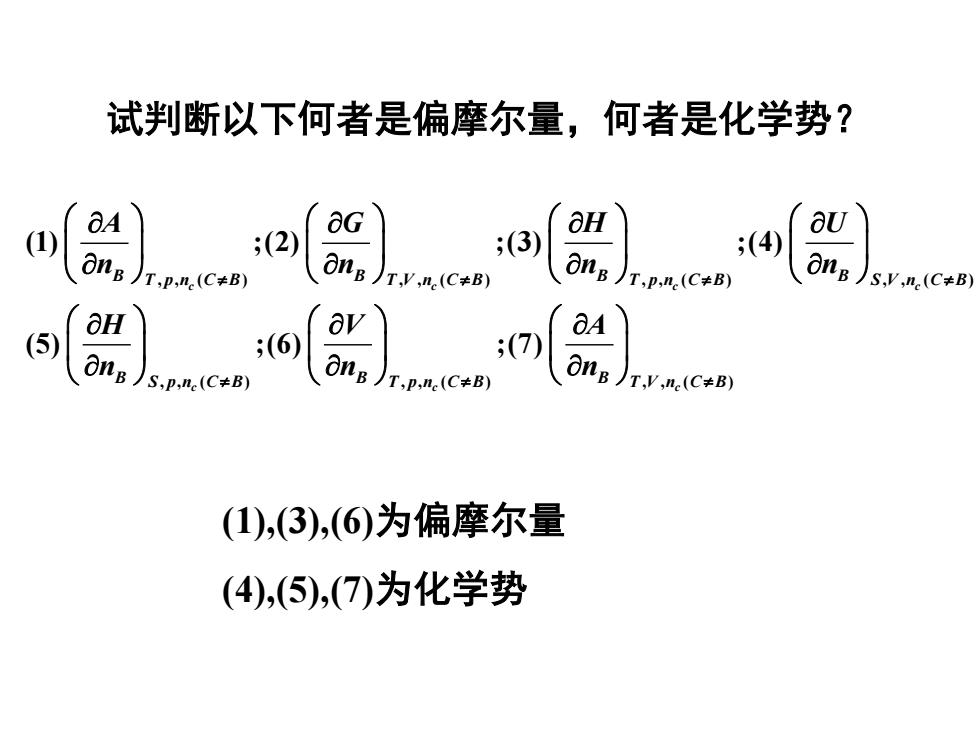
试判断以下何者是偏摩尔量,何者是化学势? OG aH (1) (2) (3) ;(4) ong )T,p.ne(C+B) onB )Ty.ne(C+B) ong )T,p.ne(C+B) onB )sy.n (C+B) aH av 6A ;(6) 7) S,p,n(C≠B) ong )T.p.ne (C+B) ong )T.y.ne(C+B) (1),(3),(6)为偏摩尔量 (4),(⑤),(7)为化学势
试判断以下何者是偏摩尔量,何者是化学势? , , ( ) , , ( ) , , ( ) , , ( ) , , ( ) , , ( ) , , ( ) (1) ;(2) ;(3) ;(4) (5) ;(6) ;(7) c c c c c c c B B B B T p n C B T V n C B T p n C B S V n C B B B B S p n C B T p n C B T V n C B A G H U n n n n H V A n n n (1),(3),(6)为偏摩尔量 (4),(5),(7)为化学势