
化学 必修 第二册 配人教版 D.NH,+HCI=NH CI D.①②④ 答案B 答案B 解析NH表现碱性时,NH→铵盐:NH表现还原性 解析多数铵盐易溶于水,受热易分解,能与碱反应生 时,NH,→含氨元素物质,产物中氨元素的价态高于一3价。 成NH2或NH,·H2O,①③⑤正确:NH,NO3中氦元素分 A项,2NH→N2,氨元素化合价升高,无铵盐生成,NH只 别为-3价、十5价,②错误:NH,HCO3或(NH)2CO2既可 表现还原性:B项,2NH→N2,6NH2→6NH,C,NH,表现 与碱反应,也可与酸反应,④错误。 还原性和碱性,故B项正确:C项,4NH→2N2,无铵盐生 4.NH的检验。 成,NH2只表现还原性;D项,NH,→NH,Cl,氨元素化合价 ()原理(离子方程式):NH+OH-ANH,+ 不变,生成铵盐,NH只表现碱性。 H2O。 4.一水合氨的性质。 (2)操作 弱碱性电离方程式为NH2·H2O=一 强碱 湿润的红色 NH十OH,能使红色石蕊试纸变蓝 铵盐(NH时) 无色气体(NH) △ 石蕊试纸 合氮不稳定性NH,·H,0△NH,+,0 (受热分解) 试纸变蓝 二、铵盐 三、氨的实验室制法 1,定义:由铵根离子和酸根离子组成的盐。 收集方法:向下排空气法 2.物理性质:绝大多数铵盐易溶于水。 NH,CI和 3.化学性质(写出下列反应的化学方程式)。 Ca(OH). 棉花作用:防止空气与NH,对流,用水 不稳定性厂NH,CI△NH,t+HCIt 或稀硫酸浸湿即可吸收多余的NH, 化 LNH.HCO,A NH,1+H20+CO,1 反应原理:Ca(OH2+2NH,C1ACaC1+2NH+2H,0 验满:湿润的红色石蕊试纸变蓝 与诚反应2NH,C1+Ca(OH2△CaC1+2NH,1+2H,0 微训练2关于铵盐的叙述:①多数铵盐易溶于水; 微判断2(1)可以用直接加热氯化铵固体的方法制 ②铵盐中氨元素均为一3价:③铵盐受热易分解:④铵盐只 各氨。 () 能与碱反应,不能与酸反应:⑤铵态氨肥不宜与碱性物质(如 (2)向某溶液中加入稀NOH溶液,若湿润的红色石蕊 草木灰)混合使用。其中正确的是( )。 试纸不变蓝,则原溶液中一定无NH时。 () A.①②③④⑤ (3)氨的制备实验中可以采用碱石灰千燥氨。() B.①③⑤ 答案(1)×(2)×(3)√ C.③④⑤ 课堂·重难突破 喷泉实验探究 ③还原性。 氨催化氧化生成NO:4NH+5O2 重难归纳 催化剂4NO十6H.O。 △ 2.喷泉实验原理。 1.氨的化学性质。 (1)使容器内外产生较大压强差的两种方法」 (1)氨的分子结构。 ①减小内压法(如图I)。 名称 化学式 电子式 结构式 容器内气体与水或 气体溶解或发 容器内 其他液体接触 生化学反应 压强减小 H N 氨 NHg H合H 外部液体迅速 H文NxH 进入形成喷泉 常见气体与吸收剂的组合 (2)氨的化学性质 ①与水反应。 CO2、Cl2 NO2和O2 a.氨易液化、极易溶于水 —喷泉实验。 气体 HCI NH, H2S、SO2 的混合气体 b.氨的水溶液是氨水。 ②与酸反应。 吸收剂水或aOH溶液 水或盐酸 NaOH溶液 水 氨与酸反应生成铵盐:NH,十H一NH。 26
化 学 必修 第二册 配人教版 D.NH3+HClNH4Cl 答案 B 解析 NH3 表现碱性时,NH3→铵盐;NH3 表现还原性 时,NH3→含氮元素物质,产物中氮元素的价态高于-3价。 A项,2NH3→N2,氮元素化合价升高,无铵盐生成,NH3 只 表现还原性;B项,2NH3→N2,6NH3→6NH4Cl,NH3 表现 还原性和碱性,故 B项正确;C项,4NH3→2N2,无铵盐生 成,NH3 只表现还原性;D项,NH3→NH4Cl,氮元素化合价 不变,生成铵盐,NH3 只表现碱性。 4.一水合氨的性质。 一水 合氨 弱碱性 → 电离方程式为 NH3·H2O NH+ 4 +OH- ,能使红色石蕊试纸 变蓝 不稳定性 (受热分解) → NH3·H2O △ NH3↑+H2O 二、铵盐 1.定义:由 铵根离子 和 酸根离子 组成的盐。 2.物理性质:绝大多数铵盐 易 溶于水。 3.化学性质(写出下列反应的化学方程式)。 微训练 2 关于铵盐的叙述:①多数铵盐易溶于水; ②铵盐中氮元素均为-3价;③铵盐受热易分解;④铵盐只 能与碱反应,不能与酸反应;⑤铵态氮肥不宜与碱性物质(如 草木灰)混合使用。其中正确的是( )。 A.①②③④⑤ B.①③⑤ C.③④⑤ D.①②④ 答案 B 解析 多数铵盐易溶于水,受热易分解,能与碱反应生 成 NH3 或 NH3·H2O,①③⑤正确;NH4NO3 中氮元素分 别为-3价、+5价,②错误;NH4HCO3 或(NH4)2CO3 既可 与碱反应,也可与酸反应,④错误。 4.NH+ 4 的检验。 (1)原理(离子方程式):NH+ 4 +OH- △ NH3↑+ H2O 。 (2)操作: 铵盐(NH+ 4 ) 强碱 △ → 无色气体(NH3) 湿润的红色 石蕊试纸 → 试纸 变蓝 三、氨的实验室制法 微判断 2 (1)可以用直接加热氯化铵固体的方法制 备氨。 ( ) (2)向某溶液中加入稀 NaOH 溶液,若湿润的红色石蕊 试纸不变蓝,则原溶液中一定无 NH+ 4 。 ( ) (3)氨的制备实验中可以采用碱石灰干燥氨。 ( ) 答案 (1)× (2)× (3)√ 课堂·重难突破 一 喷泉实验探究 重难归纳 1.氨的化学性质。 (1)氨的分子结构。 名称 化学式 电子式 结构式 氨 NH3 N H H H (2)氨的化学性质。 ①与水反应。 a.氨易液化、极易溶于水———喷泉实验。 b.氨的水溶液是氨水。 ②与酸反应。 氨与酸反应生成铵盐:NH3+H+NH+ 4 。 ③还原性。 氨催化氧化生成NO:4NH3+5O2 催化剂 △ 4NO+6H2O。 2.喷泉实验原理。 (1)使容器内外产生较大压强差的两种方法。 ①减小内压法(如图Ⅰ)。 容器内气体与水或 其他液体接触 ⇒ 气体溶解或发 生化学反应 ⇒ 容器内 压强减小 ⇒ 外部液体迅速 进入形成喷泉 常见气体与吸收剂的组合 气体 HCl NH3 CO2、Cl2、 H2S、SO2 NO2 和O2 的混合气体 吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液 水 26

第五章 化工生产中的重要非金属元素 ②增大外压法(如图Ⅱ)。 特别提醒 液氨与氨水的比较: 锥形瓶内存在挥发 液体受热挥发或发生 性液体或其他液体 化学反应产生气体 名称 液氨 氨水 锥形瓶内 锥形瓶内液体迅速 物质分类 纯净物 混合物 气压增大 流人烧瓶形成喷泉 分子:H2O、NH3·H2O 如喷雾器、人造喷泉、火山喷发等均是此原理。 粒子种类分子:NH NH3: 离子:NH、OH、H 常温常压下可以存在, 般情况下,氨水盛装在橡 常温常压下不能 存在条件 存在 皮袋、陶瓷坛里。氨水易 挥发,因此,氨水应密封保 酒精 存,且置于低温处 热水 注意:氨水的密度比水的小,氨水越浓,其密度越小。 图I 图 氨水中氮元素主要以NH·HO的形式存在,但氨水的 (2)氨溶于水的喷泉实验成功的三个关键 溶质是NH。而非NH·H2O,计算氨水的浓度时按 ①装置气密性要好。②烧瓶和气体要充分干燥。③烧 NH计算。 瓶内的氨要充满。 ?思考发现 典例剖析 下面是一则新闻报道手稿: 如图,同温同压下,两个等体积的干燥圆底烧瓶中分别 播音员手稿: 充满①NH,、②NO2,进行喷泉实验。经充分反应后,圆底烧 车上运送的液氨发生了泄漏。白色的氨浓 瓶内溶质的物质的量浓度( )。 雾不断地喷胃出来,向空气上方扩散,氨的气味 难闻,附近群众站在远处观望。在救援现场,消 NH. NO 防员一边喷水稀释泄漏的氨,一边派出两名队 员穿戴防护装备靠近泄漏口,用特种器材、纱布 和棉花进行堵漏处置。 -H2O H2O 氨是有毒气体和腐蚀品,液氨火灾爆炸的危险性为 乙类。 (1)液氨泄漏处理过程中涉及氨的哪些性质? A.①>② 提示氨是一种无色有刺激性气味的气体,密度比空气 B.①② C.①=② 的小,有毒,可以燃烧,能发生爆炸。氨是碱性气体,易溶于 D.不能确定 水,能与酸发生反应等。 (2)生活中常见的音乐喷泉产生喷泉的原理是什么?与 答案C 下图所示装置形成喷泉的原理是否相同?下图装置如何操 解析假设两个容器所处的状况均为标准状况,①中物质 作引发喷泉? 1 的量浓度计算公式为c= 22.4L·mo- V =24m0l·L1; ②中物质的量浓度计算公式为(= 22.4L·mol- 1 22.4 molL-。 学以致用 提示音乐喷泉是通过增大水的压强形成喷泉。图示 装置形成喷泉的原理是因为烧瓶中氨极易溶于水,使烧瓶内 1.如图是某课外活动小组的同学设计的4个喷泉实验 压强迅速减小形成喷泉。图示装置引发喷泉的操作是打开 方案。下列有关操作不可能引发喷泉现象的是()。 弹簧夹,挤压胶头滴管,使水进入烧瓶。 27
第五章 化工生产中的重要非金属元素 ②增大外压法(如图Ⅱ)。 锥形瓶内存在挥发 性液体或其他液体 ⇒ 液体受热挥发或发生 化学反应产生气体 ⇒ 锥形瓶内 气压增大 ⇒ 锥形瓶内液体迅速 流入烧瓶形成喷泉 如喷雾器、人造喷泉、火山喷发等均是此原理。 (2)氨溶于水的喷泉实验成功的三个关键。 ①装置气密性要好。②烧瓶和气体要充分干燥。③烧 瓶内的氨要充满。 下面是一则新闻报道手稿: 播音员手稿: 车上运送的液氨发生了泄漏。白色的氨浓 雾不断地喷冒出来,向空气上方扩散,氨的气味 难闻,附近群众站在远处观望。在救援现场,消 防员一边喷水稀释泄漏的氨,一边派出两名队 员穿戴防护装备靠近泄漏口,用特种器材、纱布 和棉花进行堵漏处置。 氨是有毒气体和腐蚀品,液氨火灾爆炸的危险性为 乙类。 (1)液氨泄漏处理过程中涉及氨的哪些性质? 提示 氨是一种无色有刺激性气味的气体,密度比空气 的小,有毒,可以燃烧,能发生爆炸。氨是碱性气体,易溶于 水,能与酸发生反应等。 (2)生活中常见的音乐喷泉产生喷泉的原理是什么? 与 下图所示装置形成喷泉的原理是否相同? 下图装置如何操 作引发喷泉? 提示 音乐喷泉是通过增大水的压强形成喷泉。图示 装置形成喷泉的原理是因为烧瓶中氨极易溶于水,使烧瓶内 压强迅速减小形成喷泉。图示装置引发喷泉的操作是打开 弹簧夹,挤压胶头滴管,使水进入烧瓶。 液氨与氨水的比较: 名称 液氨 氨水 物质分类 纯净物 混合物 粒子种类 分子:NH3 分子:H2O、NH3 ·H2O、 NH3; 离子:NH+ 4 、OH- 、H+ 存在条件 常温常压下不能 存在 常温常压下可以存在,一 般情况下,氨水盛装在橡 皮袋、陶瓷坛里。氨水易 挥发,因此,氨水应密封保 存,且置于低温处 注意:氨水的密度比水的小,氨水越浓,其密度越小。 氨水中氮元素主要以 NH3·H2O的形式存在,但氨水的 溶质是 NH3 而非 NH3 ·H2O,计算氨水的浓度时按 NH3 计算。 典例剖析 如图,同温同压下,两个等体积的干燥圆底烧瓶中分别 充满①NH3、②NO2,进行喷泉实验。经充分反应后,圆底烧 瓶内溶质的物质的量浓度( )。 A.①>② B.①<② C.①=② D.不能确定 答案 C 解析 假设两个容器所处的状况均为标准状况,①中物质 的量浓度计算公式为c= V 22.4L·mol-1 V = 1 22.4 mol·L-1; ②中物质的量浓度计算公式为c= 2 3 V 22.4L·mol-1 2 3 V = 1 22.4 mol·L-1。 学以致用 1.如图是某课外活动小组的同学设计的4个喷泉实验 方案。下列有关操作不可能引发喷泉现象的是( )。 27
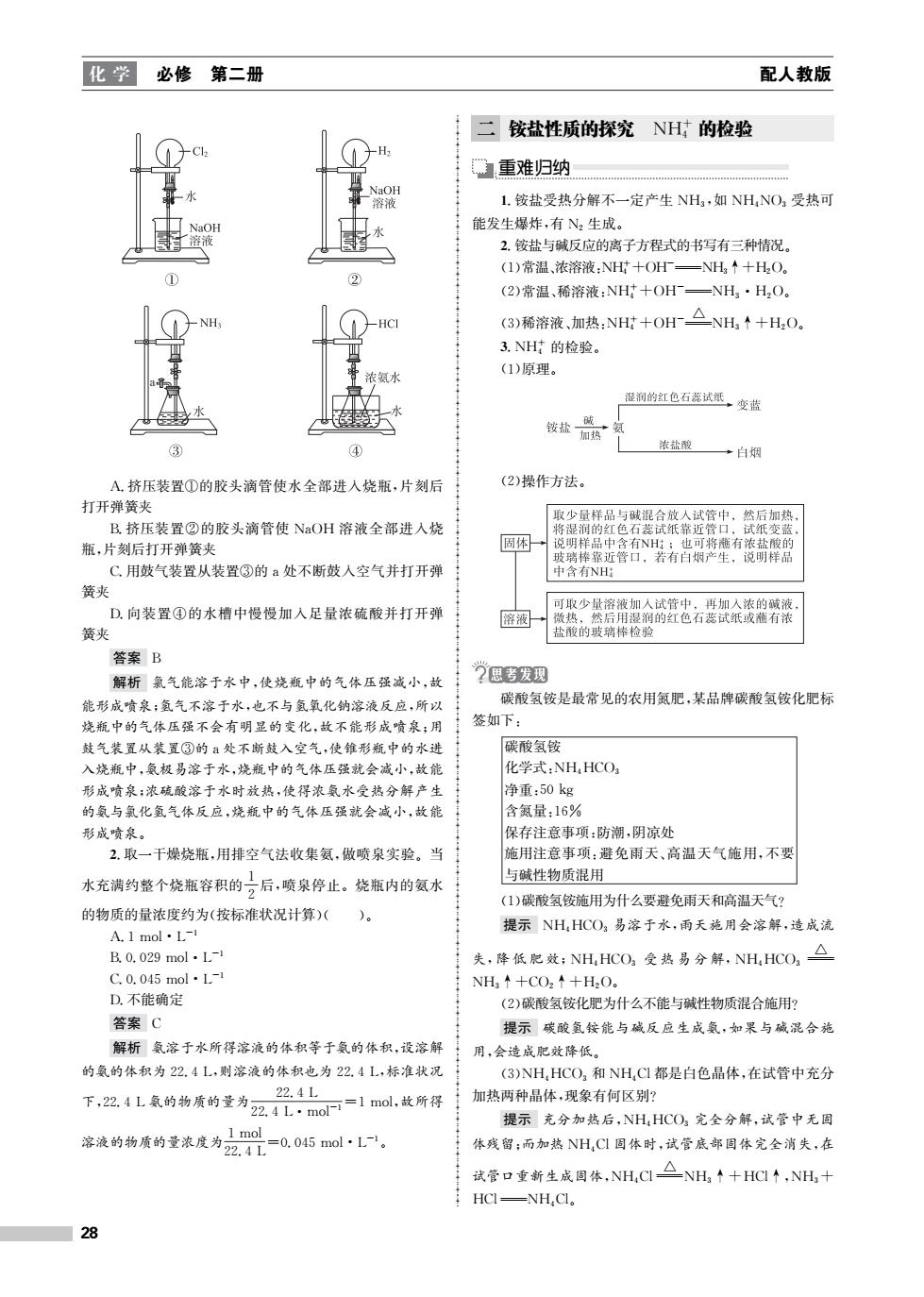
化学必修第二册 配人教版 二 铵盐性质的探究NH的检验 重难归纳 NaOH 溶液 1.铵盐受热分解不一定产生NH3,如NHNO3受热可 能发生爆炸,有八2生成。 2.铵盐与碱反应的离子方程式的书写有三种情况。 (1)常温,浓溶液:NH+OH一NH↑+H2O。 ② (2)常温、稀溶液:NH+OH—NH,·H2O。 (3)稀溶液加热:NH+OH△NH,◆+H,O。 3.NH的检验。 (1)原理。 湿润的红色石蕊试纸,变蓝 ③ ④ 浓盐酸 →白烟 A挤压装置①的胶头滴管使水全部进人烧瓶,片刻后 (2)操作方法。 打开弹簧夹 取少量样品与碱混合放人试管中,然后加热 B.挤压装置②的胶头滴管使NaOH溶液全部进入烧 将湿润的红色石蕊试纸靠近管口,试纸变蓝 瓶,片刻后打开弹簧夹 说明样品中含有NH;也可将蘸有浓盐酸的 玻璃棒靠近管口,若有白烟产生,说明样品 C.用鼓气装置从装置③的a处不断鼓入空气并打开弹 中含有NH 簧夹 可取少量溶液加入试管中,再加入浓的碱液 D.向装置④的水槽中慢慢加入足量浓硫酸并打开弹 溶液 微热,然后用湿润的红色石蕊试纸或越有浓 簧夹 盐酸的玻璃棒检验 答案B 解析氯气能溶于水中,使烧瓶中的气体压强减小,故 汽思考发现 能形成喷泉:氢气不溶于水,也不与氢氧化钠溶液反应,所以 碳酸氢铵是最常见的农用氨肥,某品牌碳酸氢铵化肥标 烧瓶中的气体压强不会有明显的变化,故不能形成喷泉:用 签如下: 鼓气装置从装置③的a处不断鼓入空气,使锥形瓶中的水进 碳酸氢铵 入烧瓶中,氨极易溶于水,烧瓶中的气体压强就会减小,故能 化学式:NH,HCOa 形成喷泉:浓硫酸溶于水时放热,使得浓氨水受热分解产生 净重:50kg 的氨与氯化氢气体反应,烧瓶中的气体压强就会减小,故能 含氮量:16% 形成喷泉。 保存注意事项:防潮,阴凉处 2.取一干燥烧瓶,用排空气法收集氨,做喷泉实验。当 施用注意事项:避免雨天、高温天气施用,不要 水充满约整个烧瓶容积的二后,喷泉停止。烧瓶内的氨水 与碱性物质混用 (1)碳酸氢铵施用为什么要避免雨天和高温天气? 的物质的量浓度约为(按标准状况计算)( 提示NH,HCO3易溶于水,雨天施用会溶解,造成流 A.1mol·L- B.0.029mol.L- 失,降低肥效:NH,HCO,受热易分解,NH,HCO,△ C.0.045mol·L- NH3↑+CO2↑+H2O。 D.不能确定 (2)碳酸氢铵化肥为什么不能与碱性物质混合施用? 答案C 提示碳酸氢铵能与碱反应生成氨,如果与碱混合施 解析氨溶于水所得溶液的体积等于氨的体积,设溶解 用会造成肥效降低。 的氨的体积为22.4L,则溶液的体积也为22.4L,标准状况 (3)NH,HCO,和NH,C都是白色晶体,在试管中充分 22.4L 下,2.4L氨的物质的量为2.4·m0=1m0,故所得 加热两种晶体,现象有何区别? 提示充分加热后,NH,HCO3完全分解,试管中无固 溶液的物质的量流定为2盟-045ml1. 体残留:而加热NHCI固体时,试管底部固体完全消失,在 试管口重新生成固体,NH,C△NH↑十HCI个,NH,十 HCI-NH,Cl。 28
化 学 必修 第二册 配人教版 A.挤压装置①的胶头滴管使水全部进入烧瓶,片刻后 打开弹簧夹 B.挤压装置②的胶头滴管使 NaOH 溶液全部进入烧 瓶,片刻后打开弹簧夹 C.用鼓气装置从装置③的a处不断鼓入空气并打开弹 簧夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开弹 簧夹 答案 B 解析 氯气能溶于水中,使烧瓶中的气体压强减小,故 能形成喷泉;氢气不溶于水,也不与氢氧化钠溶液反应,所以 烧瓶中的气体压强不会有明显的变化,故不能形成喷泉;用 鼓气装置从装置③的a处不断鼓入空气,使锥形瓶中的水进 入烧瓶中,氨极易溶于水,烧瓶中的气体压强就会减小,故能 形成喷泉;浓硫酸溶于水时放热,使得浓氨水受热分解产生 的氨与氯化氢气体反应,烧瓶中的气体压强就会减小,故能 形成喷泉。 2.取一干燥烧瓶,用排空气法收集氨,做喷泉实验。当 水充满约整个烧瓶容积的 1 2 后,喷泉停止。烧瓶内的氨水 的物质的量浓度约为(按标准状况计算)( )。 A.1mol·L-1 B.0.029mol·L-1 C.0.045mol·L-1 D.不能确定 答案 C 解析 氨溶于水所得溶液的体积等于氨的体积,设溶解 的氨的体积为22.4L,则溶液的体积也为22.4L,标准状况 下,22.4L氨的物质的量为 22.4L 22.4L·mol-1=1mol,故所得 溶液的物质的量浓度为 1mol 22.4L =0.045mol·L-1。 二 铵盐性质的探究 NH+ 4 的检验 重难归纳 1.铵盐受热分解不一定产生 NH3,如 NH4NO3 受热可 能发生爆炸,有 N2 生成。 2.铵盐与碱反应的离子方程式的书写有三种情况。 (1)常温、浓溶液:NH+ 4 +OH-NH3↑+H2O。 (2)常温、稀溶液:NH+ 4 +OH-NH3·H2O。 (3)稀溶液、加热:NH+ 4 +OH- △ NH3↑+H2O。 3.NH+ 4 的检验。 (1)原理。 (2)操作方法。 碳酸氢铵是最常见的农用氮肥,某品牌碳酸氢铵化肥标 签如下: 碳酸氢铵 化学式:NH4HCO3 净重:50kg 含氮量:16% 保存注意事项:防潮,阴凉处 施用注意事项:避免雨天、高温天气施用,不要 与碱性物质混用 (1)碳酸氢铵施用为什么要避免雨天和高温天气? 提示 NH4HCO3 易溶于水,雨天施用会溶解,造成流 失,降 低 肥 效;NH4HCO3 受 热 易 分 解,NH4HCO3 △ NH3↑+CO2↑+H2O。 (2)碳酸氢铵化肥为什么不能与碱性物质混合施用? 提示 碳酸氢铵能与碱反应生成氨,如果与碱混合施 用,会造成肥效降低。 (3)NH4HCO3 和 NH4Cl都是白色晶体,在试管中充分 加热两种晶体,现象有何区别? 提示 充分加热后,NH4HCO3 完全分解,试管中无固 体残留;而加热 NH4Cl固体时,试管底部固体完全消失,在 试管口重新生成固体,NH4Cl △ NH3↑+HCl↑,NH3+ HClNH4Cl。 28

第五章化工生产中的重要非金属元素 典例剖析 5.检验是否收集满的两种方法:一种是将湿润的红色石 蕊试纸靠近试管口,若试纸变蓝,则说明已收集满:另一种方 试管中盛有白色品体,以下检验它是不是铵盐的方法中 法是用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则 不可行的是()。 说明已收集满。 A加热,将湿润的红色石蕊试纸放在试管口 特别提醒 B.加氢氧化钠溶液,加热,将湿润的pH试纸放在试 管口 (1)制氨所用的铵盐不能是硝酸铵、碳酸铵 C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在 等。因为加热过程中硝酸铵可能发生爆炸性分解反应 试管口 D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在 (2NH,NO,△2N2个十O,个十4H,O),发生危险:而碳酸 试管口 铵受热易分解产生CO2,使生成的氨中有较多CO2杂质。 (2)Ca(OH)2不能用NaOH、KOH代替,原因如下: 答案A ①NaOH、KOH具有吸湿性,易结块,不利于产生 解析NH,遥湿润的pH试纸测得其pH大于7,遥浓 NHg: 盐酸生成白烟,使湿润的红色石蕊试纸变蓝:加热铵盐不一 ②NaOH,KOH在高温下均会腐蚀试管。 定有氨逸出。 (3)干燥剂可用碱石灰或CaO固体或NaOH固体, 学以致用 不能用酸性干燥剂(如浓硫酸、P,O)、无水氯化钙等,因 为它们均能与NH:发生反应。 为了检验某固体物质中是否含有NH,你认为下列试 (4)NH3极易溶于水,制备时尽可能使其不与水接 纸或试剂一定用不到的是()。 触以减少损失和防止倒吸现象发生。 ①蒸馏水②NaOH溶液③红色石蕊试纸④蓝色 (5)管口塞棉花的目的是防止氨与空气发生对流而 石蕊试纸⑤稀硫酸 使收集的氨不纯。 A.①⑤ B.④⑤ C.①③ ”思考发现 D.①②④ 以下是实验室制取氨的两种简便方法。 答案B 解析检验NH时,先将固体物质溶解,用到蒸馏水: 简便方法 装置 反应原理 再向溶液中滴入碱液,用到NOH溶液:加热检验是否产生 NH3,用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒靠近反 应容器口。 三 氨的实验室制备方法 重难归纳 加热浓氨水 NH,·H,O△NH, 铵盐与碱反应可生成氨,在实验室里常利用这一原理来 +H2O 制备氨。 1.实验原理:固体氯化铵与氢氧化钙混合加热制得。 2NHC+Ca(OH,△CaC,+2NH,◆+2H0 2.实验装置:利用固体与固体加热制气体的装置,如图 所示(与实验室制备氧气的发生装置相同)。 NH,CI和 将浓氨水滴加到固态碱性 Ca(OH), 物质(如CaO、NaOH、碱 浓氨水与固 石灰等)上,消耗浓氨水中 体烧碱或生 的水,同时反应放热,促进 石灰混合 NH·H2O分解产生 NHg 3.收集:用向下排空气法(因为氨的密度小于空气的 密度)。 4.干燥:碱石灰(CaO和NaOH的混合物)。 29
第五章 化工生产中的重要非金属元素 典例剖析 试管中盛有白色晶体,以下检验它是不是铵盐的方法中 不可行的是( )。 A.加热,将湿润的红色石蕊试纸放在试管口 B.加氢氧化钠溶液,加热,将湿润的 pH 试纸放在试 管口 C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在 试管口 D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在 试管口 答案 A 解析 NH3 遇湿润的pH 试纸测得其pH 大于7,遇浓 盐酸生成白烟,使湿润的红色石蕊试纸变蓝;加热铵盐不一 定有氨逸出。 学以致用 为了检验某固体物质中是否含有 NH+ 4 ,你认为下列试 纸或试剂一定用不到的是( )。 ①蒸馏水 ②NaOH 溶液 ③红色石蕊试纸 ④蓝色 石蕊试纸 ⑤稀硫酸 A.①⑤ B.④⑤ C.①③ D.①②④ 答案 B 解析 检验 NH+ 4 时,先将固体物质溶解,用到蒸馏水; 再向溶液中滴入碱液,用到 NaOH 溶液;加热检验是否产生 NH3,用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒靠近反 应容器口。 三 氨的实验室制备方法 重难归纳 铵盐与碱反应可生成氨,在实验室里常利用这一原理来 制备氨。 1.实验原理:固体氯化铵与氢氧化钙混合加热制得。 2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O 2.实验装置:利用固体与固体加热制气体的装置,如图 所示(与实验室制备氧气的发生装置相同)。 3.收集:用向下排空气法(因为氨的密度小于空气的 密度)。 4.干燥:碱石灰(CaO和 NaOH 的混合物)。 5.检验是否收集满的两种方法:一种是将湿润的红色石 蕊试纸靠近试管口,若试纸变蓝,则说明已收集满;另一种方 法是用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则 说明已收集满。 (1)制氨所用的铵盐不能是硝酸铵、碳酸铵 等。因为加热过程中硝酸铵可能发生爆炸性分解反应 (2NH4NO3 △ 2N2↑+O2↑+4H2O),发生危险;而碳酸 铵受热易分解产生CO2,使生成的氨中有较多CO2 杂质。 (2)Ca(OH)2 不能用 NaOH、KOH 代替,原因如下: ①NaOH、KOH 具有吸湿性,易结块,不利于产生 NH3; ②NaOH、KOH 在高温下均会腐蚀试管。 (3)干燥剂可用碱石灰或 CaO 固体或 NaOH 固体, 不能用酸性干燥剂(如浓硫酸、P2O5)、无水氯化钙等,因 为它们均能与 NH3 发生反应。 (4)NH3 极易溶于水,制备时尽可能使其不与水接 触以减少损失和防止倒吸现象发生。 (5)管口塞棉花的目的是防止氨与空气发生对流而 使收集的氨不纯。 以下是实验室制取氨的两种简便方法。 简便方法 装置 反应原理 加热浓氨水 NH3 · H2O △ NH3 ↑ +H2O 浓氨 水 与 固 体烧 碱 或 生 石灰混合 将浓氨水滴加到固态碱性 物质(如 CaO、NaOH、碱 石灰等)上,消耗浓氨水中 的水,同时反应放热,促进 NH3 · H2O 分 解 产 生 NH3 29
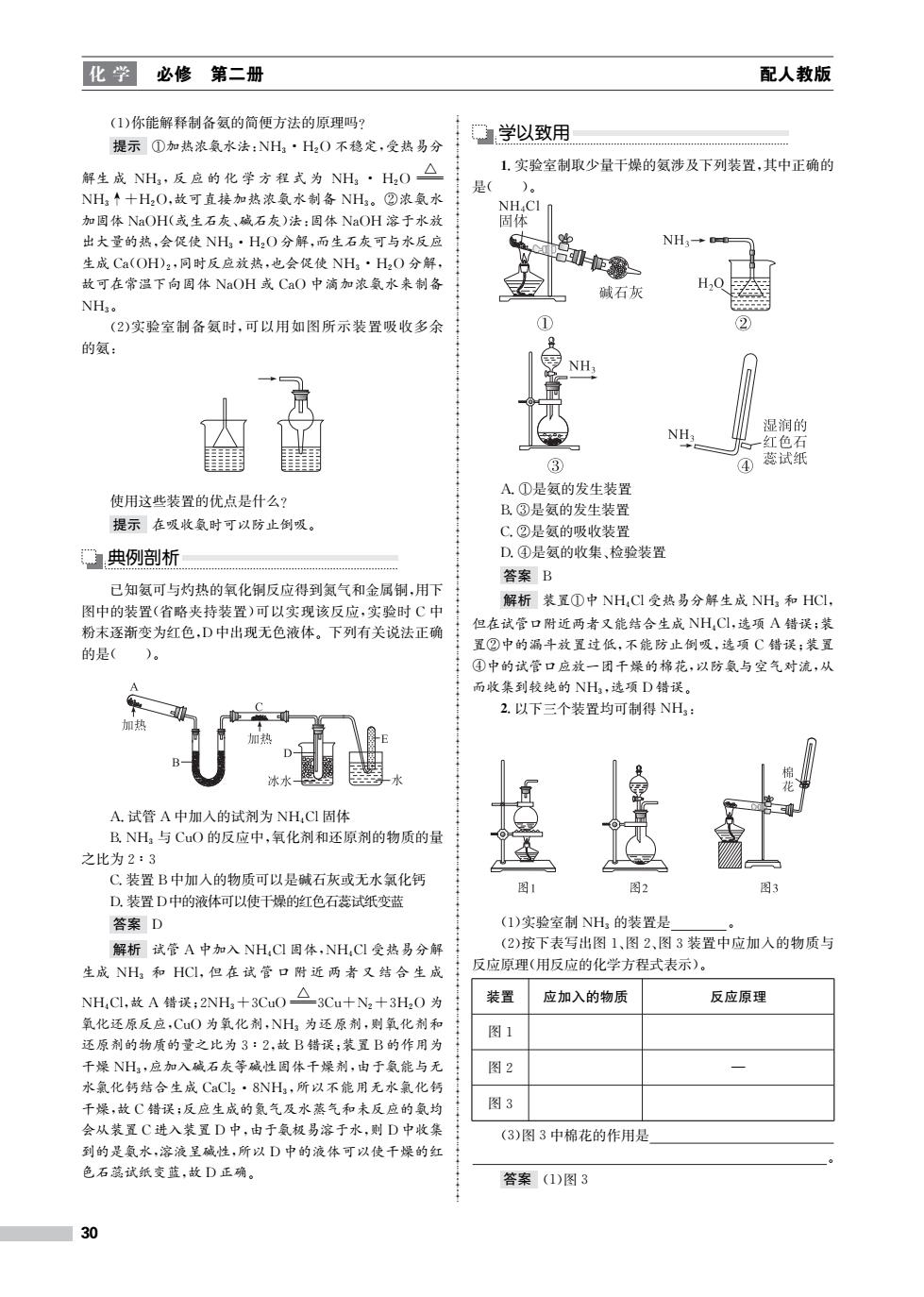
化学 必修第二册 配人教版 (1)你能解释制备氨的简便方法的原理吗? 提示①加热浓氨水法:NH·H2O不稳定,受热易分 学以致用 解生成NH,反应的化学方程式为NH,·H,O△ 1,实验室制取少量干燥的氨涉及下列装置,其中正确的 是( )。 NH↑十H2O,故可直接加热浓氨水制备NH3。②浓氨水 NH4CI 加固体NaOH(或生石灰、碱石灰)法:固体NaOH溶于水放 固体 出大量的热,会促使NH3·H2O分解,而生石灰可与水反应 NH3→ 生成Ca(OH)2,同时反应放热,也会促使NH·H2O分解, 山H一 故可在常温下向固体NaOH或CaO中滴加浓氨水来制备 碱石灰 NHg。 (2)实验室制备氨时,可以用如图所示装置吸收多余 ① 2 的氨: NH 湿润的 红色石 ③ ④ 蕊试纸 A.①是氨的发生装置 使用这些装置的优点是什么? B.③是氨的发生装置 提示在吸收氨时可以防止倒吸。 C.②是氨的吸收装置 典例剖析 D.④是氨的收集、检验装置 答案B 已知氨可与灼热的氧化铜反应得到氮气和金属铜,用下 解析装置①中NH,CI受热易分解生成NH和HCI, 图中的装置(省略夹持装置)可以实现该反应,实验时C中 粉末逐渐变为红色,D中出现无色液体。下列有关说法正确 但在试管口附近两者又能结合生成NH,C,选项A错误:装 置②中的漏斗放置过低,不能防止倒吸,选项C错误:装置 的是( )。 ④中的试管口应放一团千燥的棉花,以防氨与空气对流,从 而收集到较纯的NH3,选项D错误。 2.以下三个装置均可制得NH3: 冰水 A.试管A中加入的试剂为NH,Cl固体 B.NH与CuO的反应中,氧化剂和还原剂的物质的量 之比为2:3 C,装置B中加入的物质可以是碱石灰或无水氯化钙 图1 图2 图3 D.装置D中的液体可以使干燥的红色石蕊试纸变蓝 答案D (1)实验室制NH3的装置是 解析试管A中加入NH,CI固体,NH,C受热易分解 (2)按下表写出图1、图2、图3装置中应加入的物质与 生成NH和HCl,但在试管口附近两者又结合生成 反应原理(用反应的化学方程式表示)。 NH,CL,故A错误,2NH,+3Cu0△3Cu十N,十3H,0为 装置 应加入的物质 反应原理 氧化还原反应,CuO为氧化剂,NH3为还原剂,则氧化剂和 图1 还原剂的物质的量之比为3:2,故B错误:装置B的作用为 千燥NH,应加入碱石灰等碱性固体千燥剂,由于氨能与无 图2 水氯化钙结合生成CaC2·8NH3,所以不能用无水氯化钙 千燥,故C错误:反应生成的氮气及水蒸气和未反应的氨均 图3 会从装置C进入装置D中,由于氨极易溶于水,则D中收集 (3)图3中棉花的作用是 到的是氨水,溶液呈碱性,所以D中的液体可以使千燥的红 色石蕊试纸变蓝,故D正确。 答案(1)图3 30
化 学 必修 第二册 配人教版 (1)你能解释制备氨的简便方法的原理吗? 提示 ①加热浓氨水法:NH3·H2O不稳定,受热易分 解生 成 NH3,反 应 的 化 学 方 程 式 为 NH3 · H2O △ NH3↑+H2O,故可直接加热浓氨水制备 NH3。②浓氨水 加固体 NaOH(或生石灰、碱石灰)法:固体 NaOH 溶于水放 出大量的热,会促使 NH3·H2O分解,而生石灰可与水反应 生成Ca(OH)2,同时反应放热,也会促使 NH3·H2O分解, 故可在常温下向固体 NaOH 或 CaO 中滴加浓氨水来制备 NH3。 (2)实验室制备氨时,可以用如图所示装置吸收多余 的氨: 使用这些装置的优点是什么? 提示 在吸收氨时可以防止倒吸。 典例剖析 已知氨可与灼热的氧化铜反应得到氮气和金属铜,用下 图中的装置(省略夹持装置)可以实现该反应,实验时 C中 粉末逐渐变为红色,D中出现无色液体。下列有关说法正确 的是( )。 A.试管 A中加入的试剂为 NH4Cl固体 B.NH3 与CuO的反应中,氧化剂和还原剂的物质的量 之比为2∶3 C.装置B中加入的物质可以是碱石灰或无水氯化钙 D.装置D中的液体可以使干燥的红色石蕊试纸变蓝 答案 D 解析 试管 A中加入 NH4Cl固体,NH4Cl受热易分解 生成 NH3 和 HCl,但 在 试 管 口 附 近 两 者 又 结 合 生 成 NH4Cl,故 A 错误;2NH3+3CuO △ 3Cu+N2+3H2O 为 氧化还原反应,CuO为氧化剂,NH3 为还原剂,则氧化剂和 还原剂的物质的量之比为3∶2,故B错误;装置B的作用为 干燥 NH3,应加入碱石灰等碱性固体干燥剂,由于氨能与无 水氯化钙结合生成 CaCl2·8NH3,所以不能用无水氯化钙 干燥,故C错误;反应生成的氮气及水蒸气和未反应的氨均 会从装置C进入装置D中,由于氨极易溶于水,则D中收集 到的是氨水,溶液呈碱性,所以D中的液体可以使干燥的红 色石蕊试纸变蓝,故D正确。 学以致用 1.实验室制取少量干燥的氨涉及下列装置,其中正确的 是( )。 A.①是氨的发生装置 B.③是氨的发生装置 C.②是氨的吸收装置 D.④是氨的收集、检验装置 答案 B 解析 装置①中 NH4Cl受热易分解生成 NH3 和 HCl, 但在试管口附近两者又能结合生成 NH4Cl,选项 A错误;装 置②中的漏斗放置过低,不能防止倒吸,选项 C错误;装置 ④中的试管口应放一团干燥的棉花,以防氨与空气对流,从 而收集到较纯的 NH3,选项D错误。 2.以下三个装置均可制得 NH3: (1)实验室制 NH3 的装置是 。 (2)按下表写出图1、图2、图3装置中应加入的物质与 反应原理(用反应的化学方程式表示)。 装置 应加入的物质 反应原理 图1 图2 — 图3 (3)图3中棉花的作用是 。 答案 (1)图3 30