
教师活动 教学内容及程序 学生活动门 TB/A =mA/VB 如,T(NaOH/HC)=0.004000gmL1 就是1 mL HCl恰能与0.004000 g NaOH完全作用 提出问题 (③)物质的量浓度与滴定度的关系? 积极思考 2.3.2 基准物质与标准溶液 L.基准物质(Primary standard substance) 能够直接配制成标准溶液的纯物质 基准物质必须符合下列条件: 纯度高(>99.98%): 2 空气中稳定 用多媒体显 3)实际组成与化学式完全相符。 示 此外,试剂最好有较大的摩尔质量,可减少称量误差。 2.标准溶液浓度的选择 其浓度一般在0011m0几之间.币常要求有4位有效数字。 为控制滴定管读数的相对误差不大于0.1%,(注:完成 次滴定 整理笔记 的读数绝对误±0.02mL),则配制的标准溶液的适宜浓度是使标 准溶液体积消耗为20-30mL所需要的浓度. 2.3.3标准溶液的配制 1直接配制法 举例说明, 准确称取一定量的基准物质,溶解后定量转移到容量瓶中,稀 释至一定体积,根据称取的质量和容量瓶的体积即可计算出该标准溶 液的准确浓度。 体验、练习 引发学华同 口例如,欲配制0.01000molK2Cr207溶液1升时,首先在分 思者、 忆已有知识 析天平上精确称取2.9420克K2C207置于烧杯中,加入适 结、 ,深化、 量水溶解后,定量转移到1000L容量瓶中,再定容即得。 提升认识 2间接配制法 许多物质纯度达不到工作基准物质的要求,或它们在空气中不 稳定,则采用间接法制各 步骤: 配制成近似浓度的溶液: 标定(standardization):用工作基准试剂标定: 与标准溶液进行比较标定。 课后练习 「课外思考题1课本D514-1. [练习] 课本pp524-5,4-6,4-8,4-10 预习内容 [预习]2.4滴定分析的计算 授课情况
16 教师活动 教学内容及程序 学生活动 TB/A = mA / VB 如,T(NaOH/HCl)=0.004000 g·mL-1 就是 1mL HCl 恰能与 0.004000g NaOH 完全作用 提出问题 (3) 物质的量浓度与滴定度的关系? 积极思考 用多媒体显 示 2.3.2 基准物质与标准溶液 1. 基准物质(Primary standard substance) 能够直接配制成标准溶液的纯物质 基准物质必须符合下列条件: 1)纯度高(>99.98%); 2) 空气中稳定 3) 实际组成与化学式完全相符。 此外,试剂最好有较大的摩尔质量,可减少称量误差。 2. 标准溶液浓度的选择 ⚫ 其浓度一般在 0.01~1mol/L 之间,通常要求有 4 位有效数字。 ⚫ 为控制滴定管读数的相对误差不大于 0.1%,(注:完成一次滴定 的读数绝对误±0.02mL),则配制的标准溶液的适宜浓度是使标 准溶液体积消耗为 20~30mL 所需要的浓度. 整理笔记 举例说明, 引发学生回 忆已有知识 2.3.3 标准溶液的配制 1 直接配制法 准确称取一定量的基准物质,溶解后定量转移到容量瓶中,稀 释至一定体积,根据称取的质量和容量瓶的体积即可计算出该标准溶 液的准确浓度。 例如,欲配制 0.01000mol/LK2Cr2O7 溶液 1 升时,首先在分 析天平上精确称取 2.9420 克 K2Cr2O7 置于烧杯中,加入适 量水溶解后,定量转移到 1000mL 容量瓶中,再定容即得。 2 间接配制法 许多物质纯度达不到工作基准物质的要求,或它们在空气中不 稳定,则采用间接法制备。 步骤: 配制成近似浓度的溶液; 标定(standardization):用工作基准试剂标定; 与标准溶液进行比较标定。 体验、练习 、思考、总 结、,深化、 提升认识 课后练习 预习内容 [课外思考题] 课本 p51 4-1, 2 [练习] 课本 pp52 4-5, 4-6, 4-8, 4-10 [预习] 2.4 滴定分析的计算 授课情况

「教师活动 教学内容及程序 学生活动 本次课 来自学生的反馈 小结 ◇第2次课 课题 2.4滴定分析的计算 学时1 目标 掌握滴定分析计算的要求:基本关系式的确定的方法,计算的格式,有效数字的要求。 教学 教学滴定分析计算中的基 重点滴定分析计算中的基本关系式的确定 难点本关系式的确定 学生已有 先前知识丁 有关物质的量的计算、有效数字规则等 知识 前概念 中学持有的计算题解题习惯 主要的教学 主要教学 方法或策略 程序启发教学法 辅助手段 多媒体 基本教材 定量分析简明教程》赵士铎主编中国农业大学出版社 或主要参考书 《分析化学》华中师大等编高等教育出版社 ●教学程序表 教师活动工 教学内容及程序 学生活动 用 感知问愿,引 Powerpiont 设课堂情境,引起学生的注意,提出本节课要解决的问 发注意,明硒 显示 题 任各 24 滴定分析的计算 24.1滴定分析计算的基本关系式 引导学生推对于任一滴定反应 理 tT +aA.P T为滴定剂,A为待测物质 物质的量 动手推导,形 nA a 成概念、技能 n t t C.V-2c.V 步步讲解、[例]C202+6+14H=2Cr*+32+70 观察、模仿
17 教师活动 教学内容及程序 学生活动 本次课 小结 来自学生的反馈 第 2 次课 课题 2.4 滴定分析的计算 学时 1 教学 目标 掌握滴定分析计算的要求:基本关系式的确定的方法,计算的格式,有效数字的要求。 教学 重点 滴定分析计算中的基本关系式的确定 教学 难点 滴定分析计算中的基 本关系式的确定 学生已有 知识 先前知识 有关物质的量的计算、有效数字规则等 前概念 中学持有的计算题解题习惯 主要的教学 方法或策略 程序启发教学法 主要教学 辅助手段 多媒体 基本教材 或主要参考书 定量分析简明教程》赵士铎主编 中国农业大学出版社 《分析化学》华中师大等编 高等教育出版社 ⚫ 教学程序表 教师活动 教学内容及程序 学生活动 用 Powerpiont 显示 创设课堂情境,引起学生的注意,提出本节课要解决的问 题 感知问题,引 发注意,明确 任务 引导学生推 理 2.4 滴定分析的计算 2.4.1 滴定分析计算的基本关系式 对于任一滴定反应 tT + aA - P T 为滴定剂,A 为待测物质, 物质的量 动手推导,形 成概念、技能 一步步讲解、 [例] Cr2O7 2- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O 观察、模仿, t a n n T A = A T n t a n = A A CT VT t a C • V = •
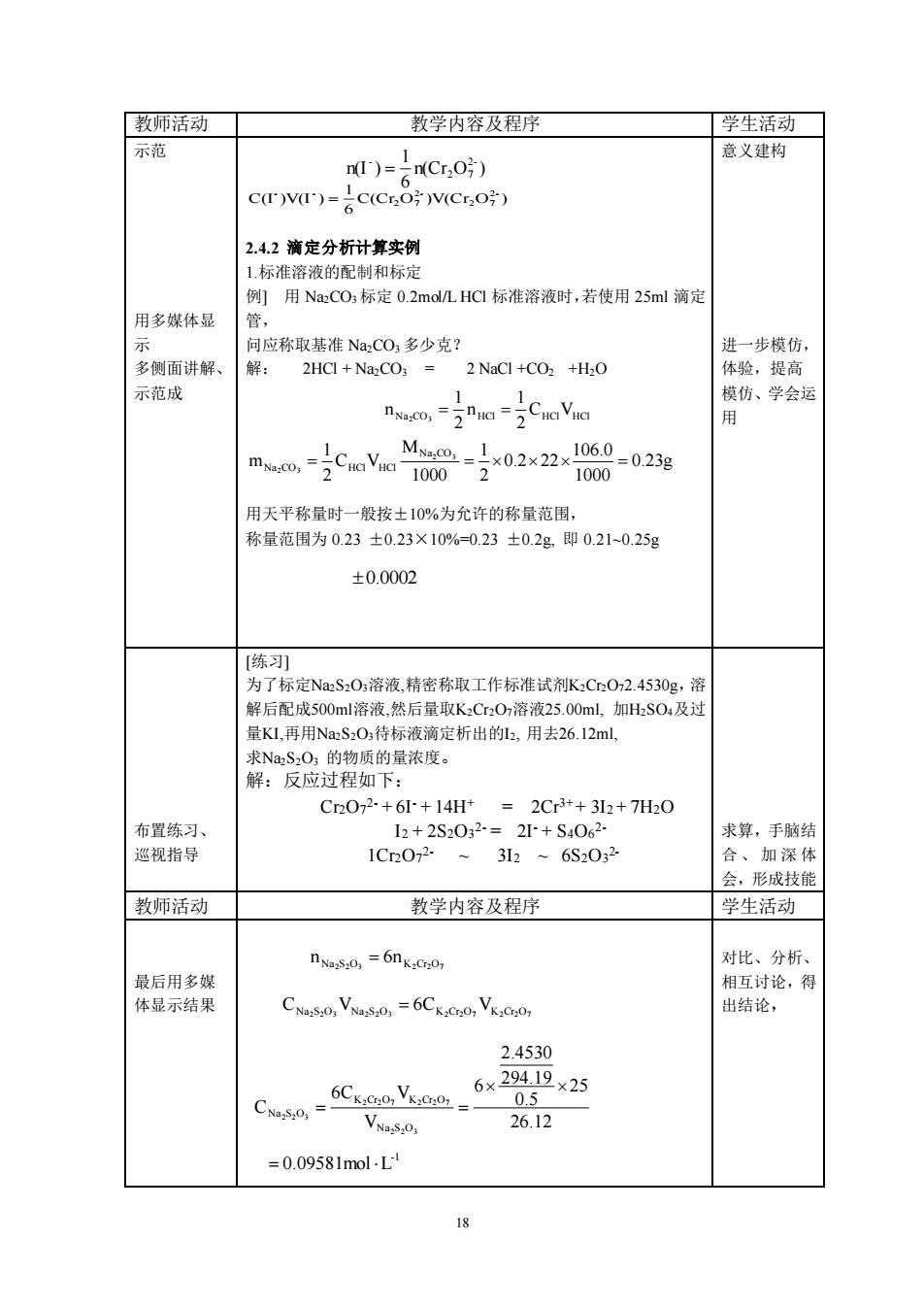
「教师活动丁 教学内容及程序 学生活动☐ 示范 n)=2C,0 意义建构 c)v)=c(COV(Cr 2.4.2滴定分析计算实例 1标准溶液的配制和标定 例]用Na:CO标定0.2 mol/L.HCl标准溶液时,若使用25ml滴定 用多媒体显 官, 问应称取基准NCO多少克? 进一步模仿, 多侧面讲解、 解: 2HCI+NazCO;2 NaCl +CO2 +H2O 体验,提高 示范成 模仿、学会运 用 1000 用天平称量时一般按+10%。为允许的称量范围 称量范围为0.23±0.23×10%-0.23±0.2g即0.210.25g ±0.0002 [练列 为了标定NaS20溶液,精密称取工作标准试剂K3CO2.4530g,溶 解后配成500ml溶液,然后量取K,Cr,0,溶液25.00ml,加HS0:及过 量K1,再用NaS2O5待标液滴定析出的2,用去26.12ml, 求Na,S,O1的物质的量浓度。 解:反应过程如下: C2072-+6+14H=2Cr3+32+7H30 布置练习、 12+2S2032=2+S4062 求算,手脑结 巡视指导 1C2072.~ 32~6S2032 合、加深体 会,形成技能 教师活动 教学内容及程序 学生活动 nas0,=6nK,00, 对比、分析 相互讨论,得 CNV=6CKCO,VKCo 出结论, 2.4530 CNa,= 6CK:0e0,Vx:e0」 6×29419×25 0.5 26.12 =0.09581mol-L
18 教师活动 教学内容及程序 学生活动 示范 意义建构 用多媒体显 示 多侧面讲解、 示范成 2.4.2 滴定分析计算实例 1.标准溶液的配制和标定 例] 用 Na2CO3 标定 0.2mol/L HCl 标准溶液时,若使用 25ml 滴定 管, 问应称取基准 Na2CO3 多少克? 解: 2HCl + Na2CO3 = 2 NaCl +CO2 +H2O 用天平称量时一般按±10%为允许的称量范围, 称量范围为 0.23 ±0.23×10%=0.23 ±0.2g, 即 0.21~0.25g 进一步模仿, 体验,提高 模仿、学会运 用 布置练习、 巡视指导 [练习] 为了标定Na2S2O3溶液,精密称取工作标准试剂K2Cr2O72.4530g,溶 解后配成500ml溶液,然后量取K2Cr2O7溶液25.00ml, 加H2SO4及过 量KI,再用Na2S2O3待标液滴定析出的I2, 用去26.12ml, 求Na2S2O3 的物质的量浓度。 解:反应过程如下: Cr2O7 2- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O I2 + 2S2O3 2- = 2I- + S4O6 2- 1Cr2O7 2- ~ 3I2 ~ 6S2O3 2- 求算,手脑结 合、加深体 会,形成技能 教师活动 教学内容及程序 学生活动 最后用多媒 体显示结果 对比、分析、 相互讨论,得 出结论, n(Cr O ) 6 1 n(I ) 2- 2 7 - = C(Cr O )V(Cr O ) 6 1 C(I )V(I ) 2- 2 7 2- 2 7 - - = 0.23g 1000 106.0 0.2 22 2 1 1000 M C V 2 1 m 2 3 2 3 Na CO Na CO = HCl HCl = = Na CO HCl CHClVHCl 2 1 n 2 1 n 2 3 = = 0.0002 Na2S2O3 K2Cr2O7 n = 6n Na2S2O3 Na2S2O3 K2Cr2O7 K2Cr2O7 C V = 6C V 26.12 25 0.5 294.19 2.4530 6 V 6C V C 2 2 3 2 2 7 2 2 7 2 2 3 Na S O K Cr O K Cr O Na S O = = -1 = 0.09581mol L

「教师活动 教学内容及程序 学生活动 提出问题,启 相互讨论,由 发学生总结 [讨论议题] 小组长总结 解题的方法 滴定分析计算的的主要步骤有哪几步?与中学化学计算题解题格 大家倾听、补 技巧 式有什么不同? 充 课后练习 「练习1课本DD524-5.4-6.4-8.4-10 预习内容 [预习]实验6酸碱标准溶液的标定 授课情况 本次课 小结 来自学生的反馈 第三章酸碱滴定法 整章计划 数1 了解酸诚质子理论 学目 2 掌握质子条件式及计算水溶液酸度的方法 3 了解酸碱指示剂的变色原理 标 4. 掌握强酸(碱)的滴定、一元弱酸(碱)、多元弱酸(碱)的滴定原理:滴定曲线、化 学计量点PH及突跃范围计算、影响突跃范用的因素 [重点]:酸碱质子理论:分析浓度与平衡浓度的概念:酸度的计算方法:酸碱指示剂 的变色范围:各种类型的滴定曲线及影响突跃的原因 重点 [难点】分析浓度与平衡浓度:质子条件式:多元酸pH的计算:混合碱的分析计算。 难点 6 先前 《普通化学》已涉及到酸碱理论,各种溶液中 学生已有知识 H值的计算。 时 知识 前概念共轭酸、共轭酸碱概念的模糊理解 主要的教学 基于概念转变的教学、局部探究法 主要教学 方法或策略 辅助手段 多煤体 基本教材 《分析化学》胡广林、许辉主编中国农业大学出版社 或主要参考书 《分析化学》华中师大等编高等教有出版社 19
19 教师活动 教学内容及程序 学生活动 提出问题,启 发学生总结 解题的方法 技巧 [讨论议题] 滴定分析计算的的主要步骤有哪几步?与中学化学计算题解题格 式有什么不同? 相互讨论,由 小组长总结, 大家倾听、补 充 课后练习 预习内容 [练习] 课本 pp52 4-5, 4-6, 4-8, 4-10 [预习]实验 6 酸碱标准溶液的标定 本次课 小结 授课情况 来自学生的反馈 第三章 酸碱滴定法 教 学 目 标 1. 了解酸碱质子理论 2. 掌握质子条件式及计算水溶液酸度的方法 3. 了解酸碱指示剂的变色原理 4. 掌握强酸(碱)的滴定、一元弱酸(碱)、多元弱酸(碱) 的滴定原理:滴定曲线、化 学计量点 PH 及突跃范围计算、影响突跃范围的因素 教学 重点 难点 [重点] :酸碱质子理论;分析浓度与平衡浓度的概念;酸度的计算方法;酸碱指示剂 的变色范围;各种类型的滴定曲线及影响突跃的原因; [难点] 分析浓度与平衡浓度;质子条件式;多元酸 pH 的计算;混合碱的分析计算。 学 时 6 学生已有 知识 先前 知识 《普通化学》已涉及到酸碱理论,各种溶液中 pH 值的计算。 前概念 共轭酸、共轭酸碱概念的模糊理解 主要的教学 方法或策略 基于概念转变的教学、局部探究法 主要教学 辅助手段 多媒体 基本教材 或主要参考书 《分析化学》胡广林、许辉主编 中国农业大学出版社 《分析化学》华中师大等编 高等教育出版社 整章计划
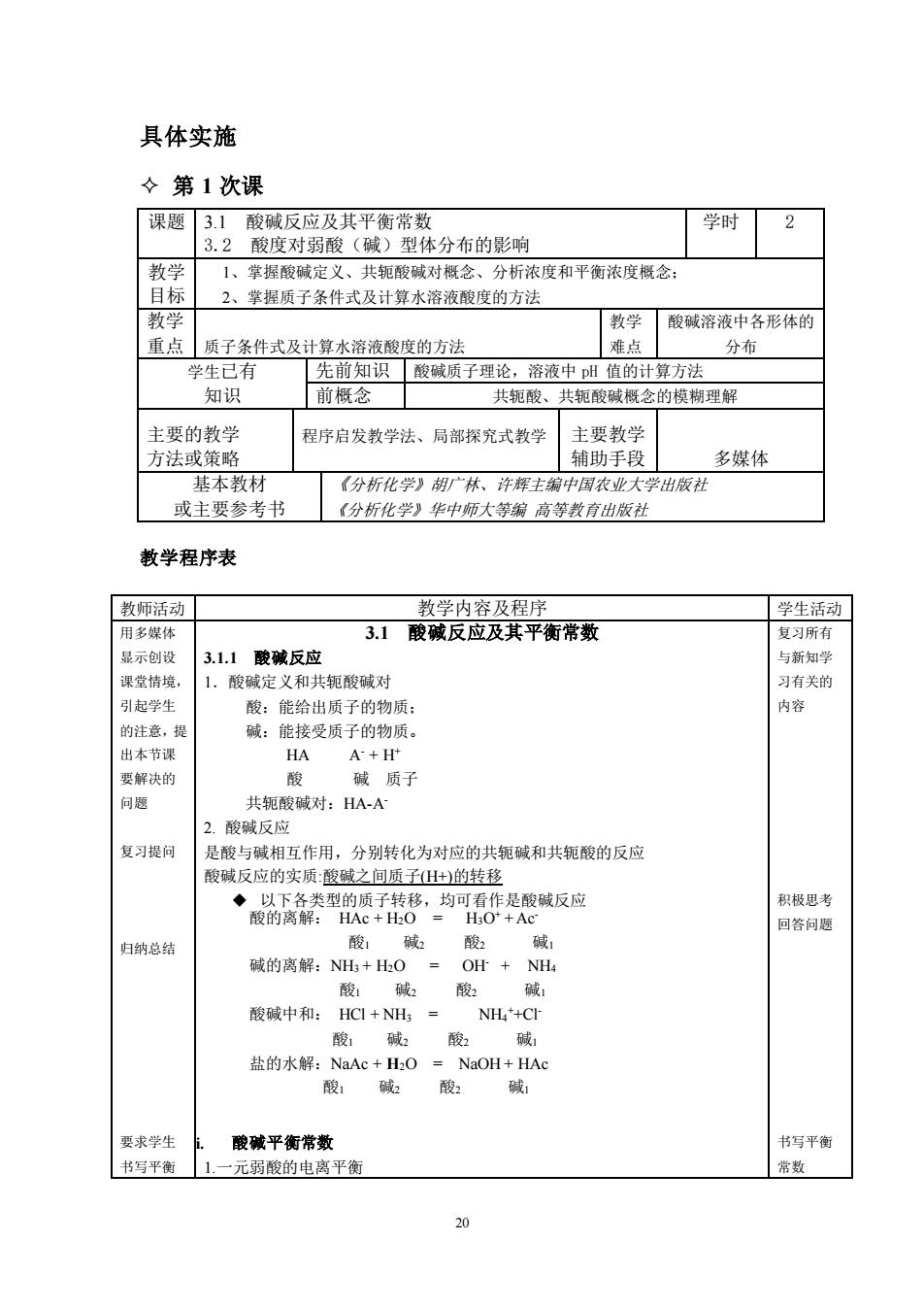
具体实施 ◇第1次课 课题3.1酸碱反应及其平衡常数 学时2 3.2酸度对弱酸(碱)型体分布的影响 教学 1、掌握酸碱定义、共轭酸碱对概念、分析浓度和平衡浓度概念 目标 2、掌握质子条件式及计算水溶液酸度的方法 教学 教学酸碱溶液中各形体的 重点质子条件式及计算水溶液酸度的方法 准占 分布 学生己有 先前知识酸碱质子理论,溶液中州值的计算方法 知识 前概念 共轭酸、共轭酸碱概念的模糊理解 主要的教学 程序启发教学法、局部探究式教学 主要教学 方法或策略 铺助手毁 多媒体 基本教材 (分析化学》胡广林、许辉主编中国农业大学出版社 或主要参考书 (分析化学》华中师大等编高等数育出版社 教学程序表 教师活动 教学内容及程序 学生活动 用多媒体 3.1酸碱反应及其平衡常数 复习所有 显示创设 3.1.1酸碱反应 与新知学 课堂情境 1.酸碱定义和共轭酸碱对 习有关的 引起学 酸:能给出质子的物质: 内容 的注意,提 碱:能接受质子的物质。 出本节词 HA A+H 要解决的 酸 碱质子 问题 共轭酸碱对:HA-A 2.酸碱反应 复习提问 是酸与碱相互作用,分别转化为对应的共轭碱和共轭酸的反应 酸碱反应的实质:酸碱之间质子+)的转移 积极思考 HO+Ac 回答问题 归钠总结 酸,碱2酸2碱 碱的离解:NH+HO=Of+NH4 酸1碱2 酸2碱 酸碱中和:HC+NH= NH+Cr 酸 碱 酸 盐的水解:NaAc+HO=NaOH+HAc 酸碱酸碱 要求学生 酸碱平衡常数 书写平衡 书写平衡 1.一元弱酸的电离平衡 常数
20 具体实施 第 1 次课 课题 3.1 酸碱反应及其平衡常数 3.2 酸度对弱酸(碱)型体分布的影响 学时 2 教学 目标 1、掌握酸碱定义、共轭酸碱对概念、分析浓度和平衡浓度概念; 2、掌握质子条件式及计算水溶液酸度的方法 教学 重点 质子条件式及计算水溶液酸度的方法 教学 难点 酸碱溶液中各形体的 分布 学生已有 知识 先前知识 酸碱质子理论,溶液中 pH 值的计算方法 前概念 共轭酸、共轭酸碱概念的模糊理解 主要的教学 方法或策略 程序启发教学法、局部探究式教学 主要教学 辅助手段 多媒体 基本教材 或主要参考书 《分析化学》胡广林、许辉主编中国农业大学出版社 《分析化学》华中师大等编 高等教育出版社 教学程序表 教师活动 教学内容及程序 学生活动 用多媒体 显示创设 课堂情境, 引起学生 的注意,提 出本节课 要解决的 问题 复习提问 归纳总结 要求学生 书写平衡 3.1 酸碱反应及其平衡常数 3.1.1 酸碱反应 1.酸碱定义和共轭酸碱对 酸:能给出质子的物质; 碱:能接受质子的物质。 HA A- + H+ 酸 碱 质子 共轭酸碱对:HA-A- 2. 酸碱反应 是酸与碱相互作用,分别转化为对应的共轭碱和共轭酸的反应 酸碱反应的实质:酸碱之间质子(H+)的转移 ◆ 以下各类型的质子转移,均可看作是酸碱反应 i. 酸碱平衡常数 1.一元弱酸的电离平衡 复习所有 与新知学 习有关的 内容 积极思考 回答问题 书写平衡 常数 酸的离解: HAc + H2O = H3O+ + Ac- 酸1 碱2 酸2 碱1 碱的离解:NH3 + H2O = OH- + NH4 酸1 碱2 酸2 碱1 酸碱中和: HCl + NH3 = NH4 ++Cl- 酸1 碱2 酸2 碱1 盐的水解:NaAc + H2O = NaOH + HAc 酸1 碱2 酸2 碱1