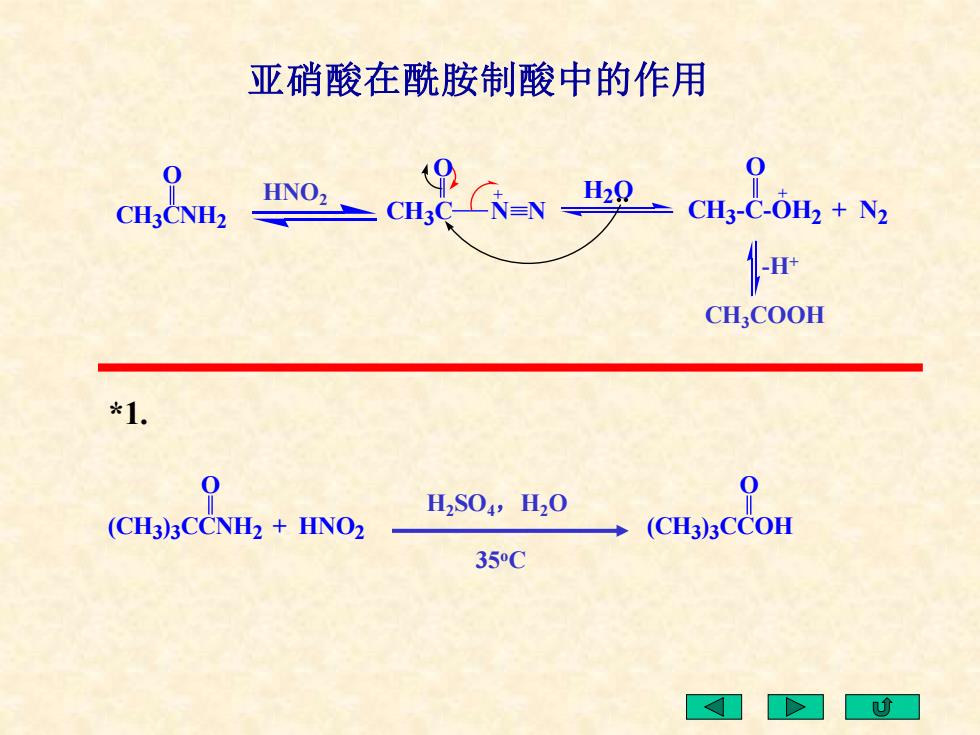
亚硝酸在酰胺制酸中的作用 cm&0cm,2y0-a,80,+N 0 CH;COOH *1. 0 H2S04,H20 0 (CH3)3CCNH2 HNO2 (CH3)3CCOH 35C
*1. O CH3CNH2 HNO2 O CH3C N N + H2O O CH3 -C-OH2 + N2 + -H+ CH3COOH O (CH3 )3CCOH O (CH3 )3CCNH2 + HNO2 H2SO4,H2O 35oC 亚硝酸在酰胺制酸中的作用

(2)酯的水解反应 *1.碱性水解(又称皂化反应) 0 0 CHsCOC+H2O CHaCONaCHOH 同位素跟踪结果表明: 碱性水解时,发生酰氧键断裂
(2) 酯的水解反应 *1. 碱性水解(又称皂化反应) O O C2H5CO 18 C2H5 + H2O CH3CONa + C2H5O 18 H NaOH 同位素跟踪结果表明: 碱性水解时,发生酰氧键断裂

反应机理 快0 R-0 -RCOH +OR' OH 四面体中间体 是负离子 0 0 ±ROH+RCO≥RCONa
O O RCOR ' + - OH RCOH + - R-C-OR' OR' OH O - 四面体中间体 是负离子 反应机理 慢 快 RCO - O Na + RCONa O ROH +

碱性水解的讨论 1.碱性水解速率与OH成正比。 2.羰基活性越大,o-C空阻越小,酯基空阻越小, 反应速率越快。 CHCOOCMe3 Me:CCOOEt CHCOOEt CICH,COOEt 相对 0.002 0.01 1 296 3.形成的四面体中间体能量越低,反应速度越快。 (能分散负电荷的取代基对反应是有利的) 4.酯的碱性水解是不可逆的。 5.碱的用量要超过催化量
碱性水解的讨论 1. 碱性水解速率与 [ -OH]成正比。 2. 羰基活性越大,-C空阻越小,酯基空阻越小, 反应速率越快。 CH3COOCMe3 Me3CCOOEt CH3COOEt ClCH2COOEt V相对 0.002 0.01 1 296 3. 形成的四面体中间体能量越低,反应速度越快。 (能分散负电荷的取代基对反应是有利的) 4. 酯的碱性水解是不可逆的。 5. 碱的用量要超过催化量

*2.酸性水解 0 H+ CH3COiC2H5+H2O CH3COH+C2H5O1H 同位素跟踪结果表明:酸性水解时,也发生酰氧键断裂。 反应机理 0 +OH OH OH H20 RCOR' -RCOR一RC-OR' H+ ±R-C-OR' 0H2 四面体中间体是正离子 OH +OH 0 -R'OH -H+ R-C-OR' RCOH RCOH HO H
*2. 酸性水解 同位素跟踪结果表明:酸性水解时,也发生酰氧键断裂。 反应机理 + - R'OH R-C-OR' + + R-C-OR' R-C-OR' -H+ OH HO H2O +OH OH RCOR' H+ RCOH +OH OH OH2 RCOH O RCOR' O H 四面体中间体是正离子 H+ CH3COH + C2H5O18H O CH3CO18C2H5 + H2O O