
泰山医学院 省级精品课程申报 分析化学实验指导实验 实验一0.1moM盐酸溶液配制(500ml)和标定 一、实验目的 熟悉滴定分析仪器基本操作,学握0.1mⅥ盐酸配制和标定方法,了解数据处理方法 二、方法原理 市售盐酸为无色透明HC1水溶液,HC1含量为36~38%(W/W),相对密度约为1.18。由于 浓盐酸易挥发放出HC1气体,若直接配制准确度差,因此配制盐酸标淮溶液需用间接配制法。 标定盐酸的基准物质常用无水碳酸钠或硼砂,本实验采用无水碳酸钠为基准物质,无水碳酸 钠易败收空气中水分,使用时先将其置于270一300℃干燥1,然后保存于干燥器中备用,其标 定反应为: Na,CO,+2HCI =2NaCl+H,0+CO, 计量点是对应碳酸饱和溶液,pH为3.9,以甲基橙作指示剂应滴至溶液呈橙色为终点,为使 碳酸的过饱和部分不断逸出,临近终点时应将溶液剧烈摇动或加热以赶走二氧化碳,冷却后再 滴定直至完全出现终点为止。 三、主要仪器和试剂 1、50ml酸式滴定管:2、250ml锥形瓶:3、500ml具塞试剂瓶:4、10ml量筒:5、甲基橙指 示剂:6、无水碳酸钠:7、电子天平:8、浓盐酸 四、实验步骤 1、0.1mo1盐酸配制(500ml) (1)计算浓盐酸的体积:0.1×0.5=12×V,则V(浓盐酸)=4.1ml (2)用10m1量筒量取4.1ml左右的浓盐酸,倒入事先洗制干净并加入少量蒸馏水的500ml具 塞细口试剂瓶中。 (3)用少量蒸馏水洗涤量筒23次,洗液一并倒入上述试剂瓶中。用不含二氧化碳蒸馏水稀释 上述溶液直到500m1(瓶肩处),盖上瓶塞翻转摇匀即可。 2、0.1mo1盐酸标定 (1)准备好标定盐酸的相应仪器(酸式滴定管、电子天平、锥形瓶等)。 (2)在电子天平上准确称取0.11-0.12g无水碳酸钠3份,分别置于洗制干净的250ml锥形瓶中, 并记下每个锥形瓶中碳酸钠的质量,每个锥形瓶中加入25ml蒸馏水溶解(保证瓶中不能有结块 的碳酸钠),滴定时在锥形瓶中加3滴甲基橙指示剂(不滴定的锥形瓶先不要提前加指示剂)

@泰山医学院 Medical Universit 省级精品课程申报 平摇锥形瓶(溶液呈黄色)。 (3)用上述配制的盐酸溶液润洗酸式滴定管2-3次后,装好盐酸溶液,赶去尖嘴中气泡,调整 好盐酸液血(每次尽可能都从零刻度开始),左手控制酸式滴定管旋塞,右手控制锥形瓶,开始 用盐酸溶液滴定,边滴定边平摇,直到锥形瓶里溶液颜色由黄色刚好变为橙色时停止滴定(滴 定终点),记下所用盐酸的体积。 (4)重复步骤(3)的操作,直至滴定完另外两个锥形瓶里的溶液为止,计算盐酸标准溶液的 浓度。其相对平均偏差不得大于0.3%。 五、数据记录与处理 1、处理公式:Ca=MVn 2m,cm,×10 -(mol /1)Mc=105.99g/mol 2、数据记录 名称 1 2 m(碳酸钠)/g V(盐酸)/ml C(盐酸)/11 C(半均值)/o1 相对平均偏差 六、问题讨论 1、为什么用甲基橙作指示剂?临近终点为什么将锥形瓶内的溶液剧烈摇动? 2、如果基准物没有烘干,将使标定结果偏高还是偏低,为什么? 实验二混合碱试样成分确定和含量测定 一、实验目的 熟悉滴定分析仪器操作,掌握混合碱分析原理,学会双指示剂判断终点 二、方法原理 混合碱主要是碳酸钠与氢氧化钠或碳酸钠与碳酸氢钠的混合物,可采用双指示剂法进行分析, 测定各组分的含量。 在混合碱试液中先加入酚酞指示剂,用盐酸标准溶液滴定至溶液呈微红色。此时试液中所含

圆泰山医学院 省级精品课程申报 氢氧化钠完全被中和,碳酸钠只被滴定成碳酸氢钠,反应如下: NaOH HCI NaCl+H,O,Na,CO+HCI NaCl NaHCO 设滴定消耗盐酸溶液体积为V1(m)。在上述溶液中再加入甲基橙指示剂,继续用盐酸标准溶 液滴定至溶液由黄色变为橙色即为终点。此时碳酸氢钠被中和成碳酸,反应式为: NaHCO,+HCI=NaCl +H,0+CO. 设此时消耗盐酸标准溶液体积为V(m)。根据V1(ml)和Vz(m可以判断出混合碱的组成。设 混合碱试液的体积为V(m。 三、主要仪器和试剂 1、50m1酸式滴定管:2、250ml锥形瓶:3、250m1容量瓶:4、25ml移液管:5、酚酞和甲基 橙指示剂:6、混合碱试样:7、电子天平:8、吸耳球:9、盐酸标准溶液:10、100m1小烧杯: 11、酒精灯和石棉网 四、实验步骤 1、准各好混合碱分析所用仪器 2、混合碱溶液制备 准确称取混合碱样品约2g左右,放入100m1烧杯中,加50m1蒸馏水溶解,然后将溶液定量 转移到250ml容量瓶中,充分摇匀。 3、混合碱分析 (1)用移液管吸取25.00ml混合碱试液于250ml锥形瓶中,加3滴酚酞指示剂,用盐酸标准 溶液滴定至溶液由红色变为微红色或浅粉红色(加一张白纸作背景能看出红色才为准确)时为 第一滴定终点,记下盐酸标准溶液的体积Vml,重新用盐酸标准溶液调整到刻度0.00ml后在 进行下一步操作。该步滴定要保证盐酸逐滴滴入,并不断振摇溶液,防止盐酸局部过浓而有二 氧化碳逸出,造成滴定结果不准确。 (2)在上述锥形瓶中再加入3滴甲基橙指示剂,继续用盐酸标准溶液滴定至溶备液由黄色恰 好变为橙色,将锥形瓶置石棉网上加热微沸1-2mm,冷却(可用冷水浴冷却)后溶液又变黄色 (如果不变仍为橙色,则表明终点已过),再小心慢慢用盐酸滴定至橙色即为第二滴定终点,记 下第二次用去盐酸标准溶液体积Vzml。平行测定三次,根据V1、V2大小判断混合碱组成,计 算各组分的含量。 五、数据记录与处理1、处理公式 (1)V)Va: 2Y2×CHa×Mo,co 25.00 2×25.00
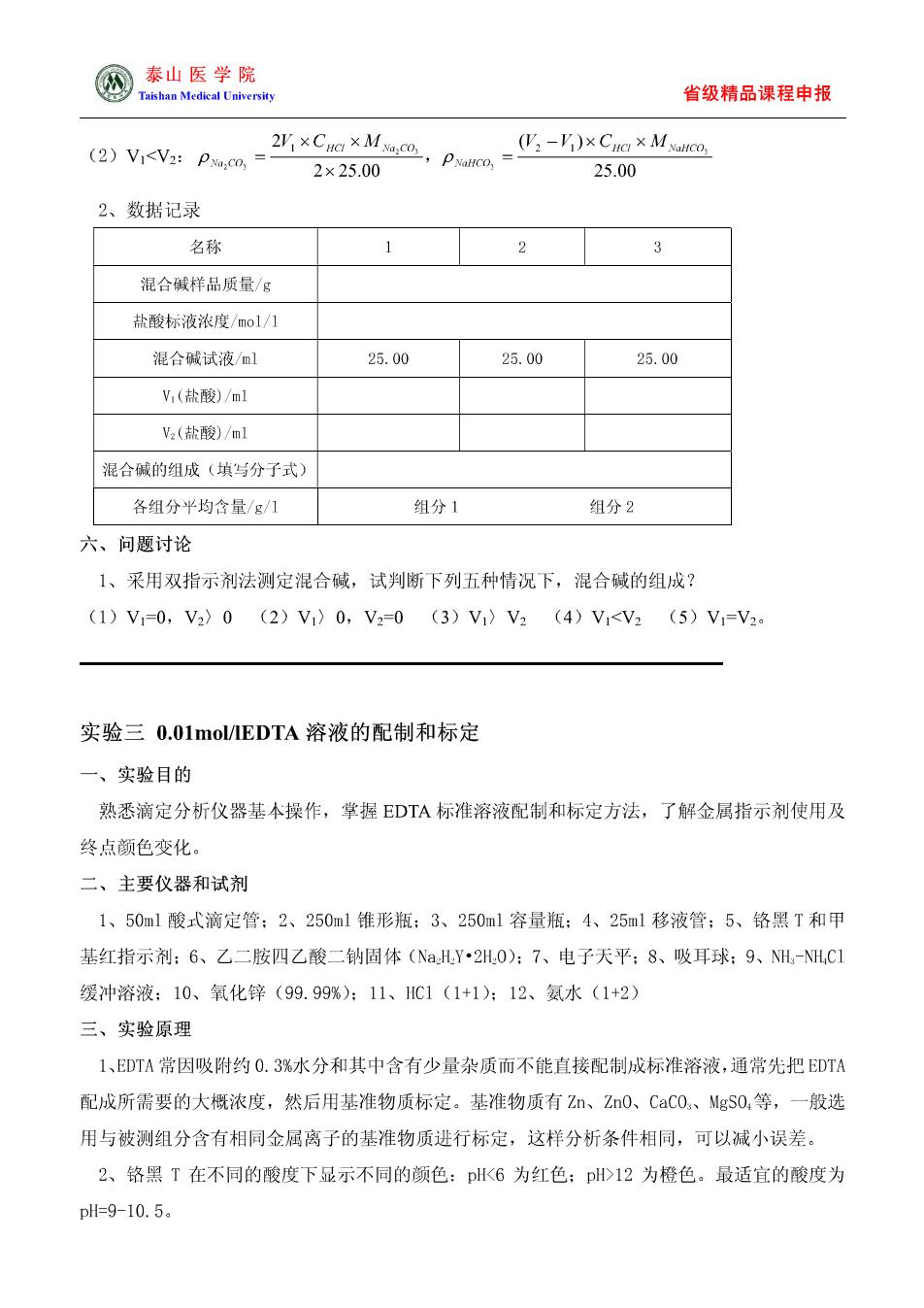
④泰山医学院 省级精品课程申报 (2)V1<V2:pw,m 2*,Pm5-xMm 2×25.00 2500 2、数据记录 名称 2 3 混合碱样品质量/g 盐酸标液浓度/mo1/1 混合碱试液/l 25.00 25.00 25.00 V(盐酸)/ml V(盐酸)/ml 混合碱的组成(填写分子式) 各组分平均含量/g/1 组分1 组分2 六、问题讨论 1、采用双指示剂法测定混合碱,试判断下列五种情况下,混合碱的组成? (1)V1=0,V2)0(2)V1〉0,V20(3)V)V2(4)V1<V2(5)V1=V2 实验三0.01 mol/IEDTA溶液的配制和标定 一、实验目的 熟悉滴定分析仪器基本操作,掌握EDTA标淮溶液配制和标定方法,了解金属指示剂使用及 终点颜色变化。 二、主要仪器和试剂 1、50m1酸式滴定管:2、250m1锥形瓶:3、250m1容量瓶:4、25m1移液管:5、铬黑T和甲 基红指示剂:6、乙二胺四乙酸二钠固体(NHY2H0):7、电子天平;8、败耳球:9、NH-NH,C] 缓冲溶液:10、氧化锌(99.99%):11、HC1(1+1):12、氨水(1+2》 三、实验原理 1、EDTA常因吸附约0.3%水分和其中含有少量杂质而不能直接配制成标准溶液,通常先把EDTA 配成所需要的大概浓度,然后用基准物质标定。基准物质有Zn、Z0、CaC0、MgS0,等,一般选 用与被测组分含有相同金屈离子的基淮物质进行标定,这样分析条件相同,可以减小误差。 2、铬黑T在不同的酸度下显示不同的颜色:pK6为红色:p少>12为橙色。最适宜的酸度为 pll=9-10.5

圆泰山医学院 省级精品课程申报 3、p为10条件下,以铬黑T为指示剂,终点由紫红色变为纯蓝色。 Zn+Hn'-=Znln +H Zn2+HY2-=Zny2-+2H' Znln +HY2-=ZnY2-+HIn+H 四、实验步骤 1、准备好酸式滴定管和相关的分析仪器并洗涮干净 2、0.01mo/EDTA标准溶液的配制 称取EDTA二钠盐(分析纯)1.9g于250ml烧杯中,加蒸馏水150ml,加热溶解,必要时过 滤。冷却后用蒸馏水稀释至500ml,摇匀,保存在细口瓶中 3、NH-H,C1缓冲溶液(pH10)配制:称取氯化铵固体154g加蒸馏水溶解,加相对密度为 0.9的浓氨水380ml,再加蒸馏水稀释至1L。 4、氧化锌基准溶液的配制 准确称取经110℃烘干至恒重的基准物氧化锌约0.20-0.22g,加入3m1稀盐酸使之溶解。将 此溶液全部转移至2501容量瓶中,用水冲洗烧杯壁几次,洗液一并转移到容量瓶中,用水稀 释至刻度摇匀。 5、标准溶液的标定 (1)用移液管移取基准溶液25.00ml于锥形瓶中,加1滴甲基红,用胶头滴管吸取稀氨水滴 加基准溶液有红色变微黄色溶液时即可。 (2)在上述溶液中加20ml蒸馏水、10ml缓冲溶液和3滴铬黑T指示剂,用配制的EDTA滴 定至溶液由酒红色变为纯蓝色即为终点,记录消耗DTA溶液的体积。平行测定3次 五、数据记录和处理 1、数据记录 名称 1 3 氧化锌基准溶液体积/ml 25.00 25.0025.00 氧化锌基准溶液浓度/mol/1 EDTA溶液体积/ml EDTA溶液浓度mol/1 EDTA溶液平均浓度/mol/1 相对平均偏差 mz0×10×100 2、处理公式Ca4=VM2m M(氧化锌)=81.38g/mol: