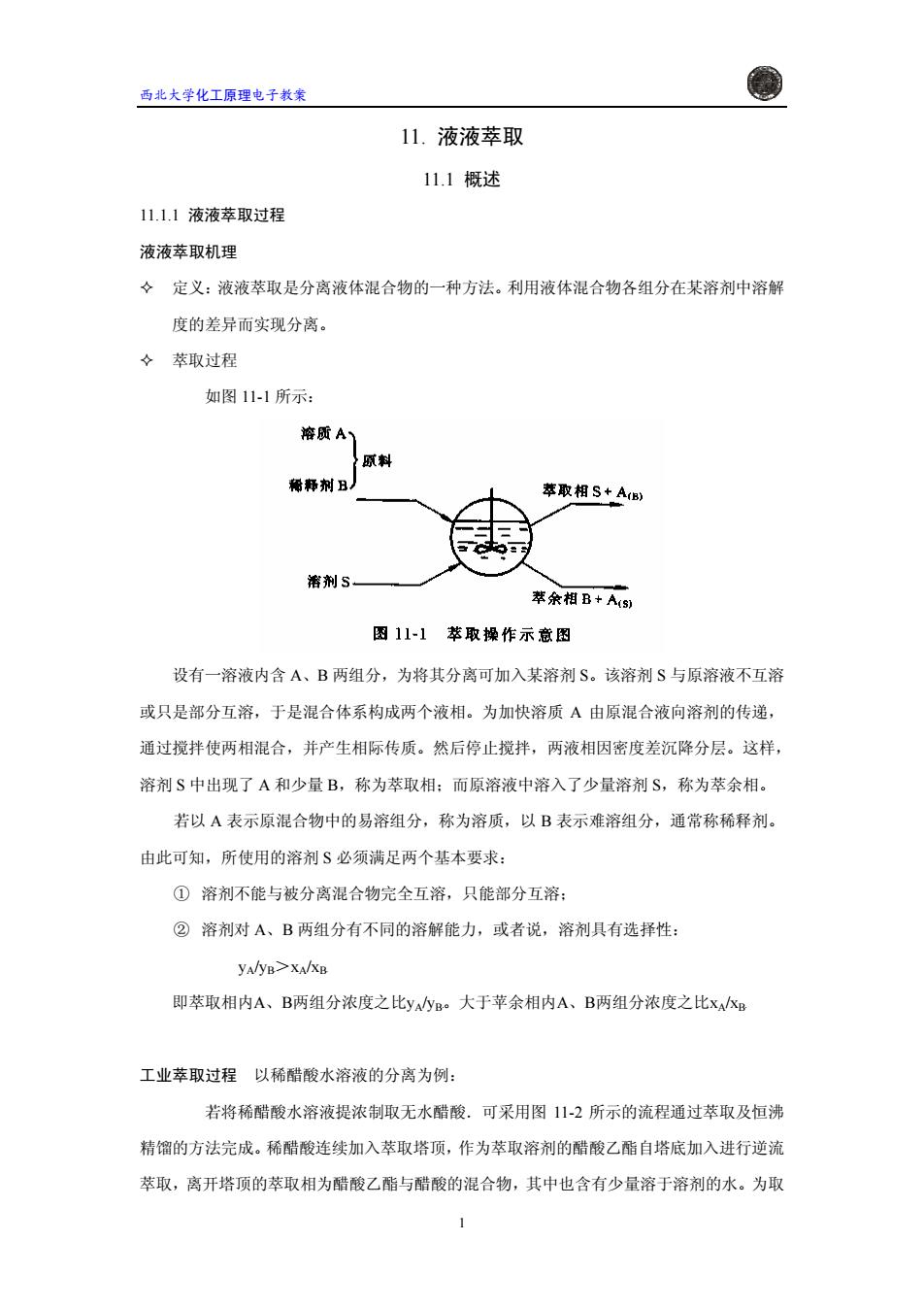
西北大学化工原理电子教案 11.液液萃取 11.1概述 11.1.1液液萃取过程 液液萃取机理 ◇定义:液液萃取是分离液体混合物的一种方法。利用液体混合物各组分在某溶剂中溶解 度的差异而实现分离。 女萃取过程 如图11-1所示: 溶质A、 原料 稀释剂B 萃取相S+AB) 溶剂S 萃余相B+A(s) 图11-1萃取操作示意图 设有一溶液内含A、B两组分,为将其分离可加入某溶剂S。该溶剂S与原溶液不互溶 或只是部分互溶,于是混合体系构成两个液相。为加快溶质A由原混合液向溶剂的传递, 通过搅拌使两相混合,并产生相际传质。然后停止搅拌,两液相因密度差沉降分层。这样, 溶剂S中出现了A和少量B,称为萃取相:而原溶液中溶入了少量溶剂S,称为萃余相。 若以A表示原混合物中的易溶组分,称为溶质,以B表示难溶组分,通常称稀释剂。 由此可知,所使用的溶剂S必须满足两个基本要求: ①溶剂不能与被分离混合物完全互溶,只能部分互溶: ②溶剂对A、B两组分有不同的溶解能力,或者说,溶剂具有选择性: yA/yB>XA/XB 即萃取相内A、B两组分浓度之比yayB。大于苹余相内A、B两组分浓度之比xAkg 工业萃取过程以稀醋酸水溶液的分离为例: 若将稀醋酸水溶液提浓制取无水醋酸.可采用图11-2所示的流程通过萃取及恒沸 精馏的方法完成。稀醋酸连续加入萃取塔顶,作为萃取溶剂的醋酸乙酯自塔底加入进行逆流 萃取,离开塔顶的萃取相为醋酸乙酯与醋酸的混合物,其中也含有少量溶于溶剂的水。为取
西北大学化工原理电子教案 11. 液液萃取 11.1 概述 11.1.1 液液萃取过程 液液萃取机理 定义:液液萃取是分离液体混合物的一种方法。利用液体混合物各组分在某溶剂中溶解 度的差异而实现分离。 萃取过程 如图 11-1 所示: 设有一溶液内含 A、B 两组分,为将其分离可加入某溶剂 S。该溶剂 S 与原溶液不互溶 或只是部分互溶,于是混合体系构成两个液相。为加快溶质 A 由原混合液向溶剂的传递, 通过搅拌使两相混合,并产生相际传质。然后停止搅拌,两液相因密度差沉降分层。这样, 溶剂 S 中出现了 A 和少量 B,称为萃取相;而原溶液中溶入了少量溶剂 S,称为萃余相。 若以 A 表示原混合物中的易溶组分,称为溶质,以 B 表示难溶组分,通常称稀释剂。 由此可知,所使用的溶剂 S 必须满足两个基本要求: ① 溶剂不能与被分离混合物完全互溶,只能部分互溶; ② 溶剂对 A、B 两组分有不同的溶解能力,或者说,溶剂具有选择性: yA/yB>B xA/xBB 即萃取相内A、B两组分浓度之比yA/yB。大于苹余相内 B A、B两组分浓度之比xA/xBB 工业萃取过程 以稀醋酸水溶液的分离为例: 若将稀醋酸水溶液提浓制取无水醋酸.可采用图 11-2 所示的流程通过萃取及恒沸 精馏的方法完成。稀醋酸连续加入萃取塔顶,作为萃取溶剂的醋酸乙酯自塔底加入进行逆流 萃取,离开塔顶的萃取相为醋酸乙酯与醋酸的混合物,其中也含有少量溶于溶剂的水。为取 1��
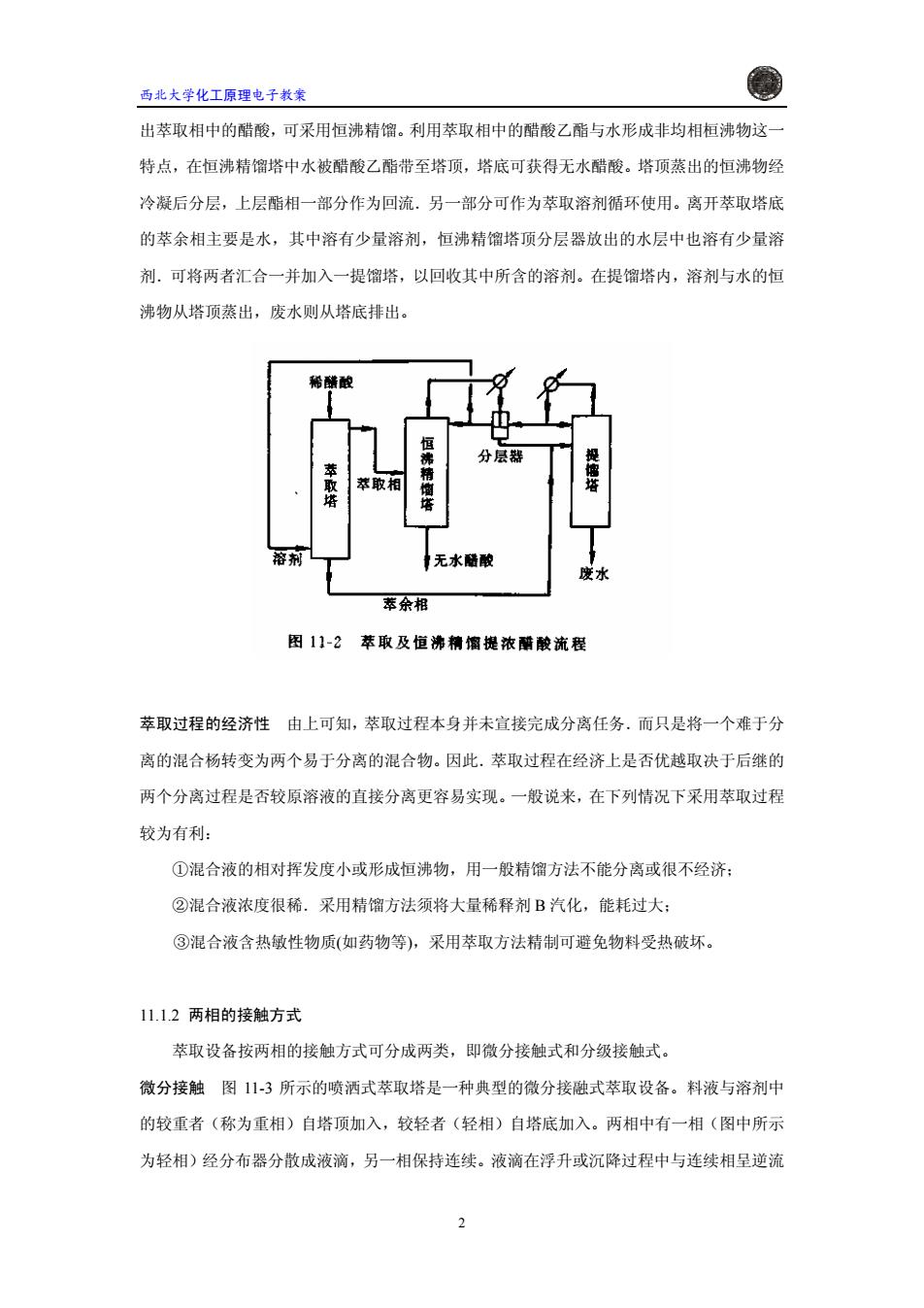
西北大学化工原理电子教案 出萃取相中的醋酸,可采用恒沸精馏。利用萃取相中的醋酸乙酯与水形成非均相桓沸物这一 特点,在恒沸精馏塔中水被醋酸乙酯带至塔顶,塔底可获得无水醋酸。塔顶蒸出的恒沸物经 冷凝后分层,上层酯相一部分作为回流.另一部分可作为萃取溶剂循环使用。离开萃取塔底 的萃余相主要是水,其中溶有少量溶剂,恒沸精馏塔顶分层器放出的水层中也溶有少量溶 剂.可将两者汇合一并加入一提馏塔,以回收其中所含的溶剂。在提馏塔内,溶剂与水的恒 沸物从塔顶蒸出,废水则从塔底排出。 稀醋酸 分层器 萃取塔 萃取相 精馆 提馆塔 溶剂 无水酷酸 废水 萃余相 图11-2萃取及恒沸精馏提浓醋酸流程 萃取过程的经济性由上可知,萃取过程本身并未宣接完成分离任务.而只是将一个难于分 离的混合杨转变为两个易于分离的混合物。因此.萃取过程在经济上是否优越取决于后继的 两个分离过程是否较原溶液的直接分离更容易实现。一般说来,在下列情况下采用萃取过程 较为有利: ①混合液的相对挥发度小或形成恒沸物,用一般精馏方法不能分离或很不经济: ②混合液浓度很稀.采用精馏方法须将大量稀释剂B汽化,能耗过大: ③混合液含热敏性物质(如药物等),采用萃取方法精制可避免物料受热破坏。 11.1.2两相的接触方式 萃取设备按两相的接触方式可分成两类,即微分接触式和分级接触式。 微分接触图11-3所示的喷洒式萃取塔是一种典型的微分接融式萃取设备。料液与溶剂中 的较重者(称为重相)自塔顶加入,较轻者(轻相)自塔底加入。两相中有一相(图中所示 为轻相)经分布器分散成液滴,另一相保持连续。液滴在浮升或沉降过程中与连续相呈逆流 2
西北大学化工原理电子教案 出萃取相中的醋酸,可采用恒沸精馏。利用萃取相中的醋酸乙酯与水形成非均相桓沸物这一 特点,在恒沸精馏塔中水被醋酸乙酯带至塔顶,塔底可获得无水醋酸。塔顶蒸出的恒沸物经 冷凝后分层,上层酯相一部分作为回流.另一部分可作为萃取溶剂循环使用。离开萃取塔底 的萃余相主要是水,其中溶有少量溶剂,恒沸精馏塔顶分层器放出的水层中也溶有少量溶 剂.可将两者汇合一并加入一提馏塔,以回收其中所含的溶剂。在提馏塔内,溶剂与水的恒 沸物从塔顶蒸出,废水则从塔底排出。 萃取过程的经济性 由上可知,萃取过程本身并未宣接完成分离任务.而只是将一个难于分 离的混合杨转变为两个易于分离的混合物。因此.萃取过程在经济上是否优越取决于后继的 两个分离过程是否较原溶液的直接分离更容易实现。一般说来,在下列情况下采用萃取过程 较为有利: ①混合液的相对挥发度小或形成恒沸物,用一般精馏方法不能分离或很不经济; ②混合液浓度很稀.采用精馏方法须将大量稀释剂 B 汽化,能耗过大; ③混合液含热敏性物质(如药物等),采用萃取方法精制可避免物料受热破坏。 11.1.2 两相的接触方式 萃取设备按两相的接触方式可分成两类,即微分接触式和分级接触式。 微分接触 图 11-3 所示的喷洒式萃取塔是一种典型的微分接融式萃取设备。料液与溶剂中 的较重者(称为重相)自塔顶加入,较轻者(轻相)自塔底加入。两相中有一相(图中所示 为轻相)经分布器分散成液滴,另一相保持连续。液滴在浮升或沉降过程中与连续相呈逆流 2

西北大学化工原理电子教案 接触进行物质传递,最后轻重两相分别从塔顶与塔底排出。 轻相出口 分层界面 料液 溶剂 相 混和器 沉降槽 轻相 轻相 重相出口 图11-3喷酒萃取培 图11-4单级混和沉降槽 级式接触级式萃取设备常采用混和沉降槽。图11-4为单级连续萃取装置,它包括混合器 和沉降槽两个部分,常称为混和沉降槽。料液和溶剂连续加入混合器,在搅拌浆作用下,一 相被分散成小液滴,均匀的分布于另一相中。自混和器流出的两相混合物在沉降槽内分层并 分别排出。 11.2液液相平衡衡 11.2.1三角形相图 溶液组成的表示方法在双组分溶液的萃取分离中,萃取相及萃余相一般都是三组分溶液。 表示三组分溶液的组成可用三角形相图。如图11-6所示的三角形范围内可表示任何三元溶 液的组成。三角形的三个顶点分别表示三个 纯组分,而三条边上的任何一点则表示相应 的双组分溶液。表示溶液组成的三角形图可 以是等腰的或等边的,也可以是非等腰的。 当萃取操作中溶质A的质量分数很低时, 7 常将AB边的比例放大,以提高图示的准确 度。 s 0.28s 0.4ys 0.6 .òS 物料衡算与杠杆定律设有组成为XA.XB.XS 图11-6溶液组成的表示法
西北大学化工原理电子教案 接触进行物质传递,最后轻重两相分别从塔顶与塔底排出。 级式接触 级式萃取设备常采用混和沉降槽。图 11-4 为单级连续萃取装置,它包括混合器 和沉降槽两个部分,常称为混和沉降槽。料液和溶剂连续加入混合器,在搅拌浆作用下,一 相被分散成小液滴,均匀的分布于另一相中。自混和器流出的两相混合物在沉降槽内分层并 分别排出。 11.2 液液相平衡 11.2.1 三角形相图 溶液组成的表示方法 在双组分溶液的萃取分离中,萃取相及萃余相一般都是三组分溶液。 表示三组分溶液的组成可用三角形相图。如图 11-6 所示的三角形范围内可表示任何三元溶 液的组成。三角形的三个顶点分别表示三个 纯组分,而三条边上的任何一点则表示相应 的双组分溶液。表示溶液组成的三角形图可 以是等腰的或等边的,也可以是非等腰的。 当萃取操作中溶质 A 的质量分数很低时, 常将 AB 边的比例放大,以提高图示的准确 度。 物料衡算与杠杆定律 设有组成为xA、xB、xS 3

西北大学化工原理电子教案 (R点)的溶液Rkg及组成为yA、yB、ys(E点)溶液Ekg,若将两溶液互相混合,形成的混 合物总量为Mkg,组成为zA、ZB、Zs,此组成可用图11-6总的M点表示。对该体系进行物料 衡算,可得衡算式如下: M-R+E MxA=RxA十EyA (11-2) Mgs=Rxs十E% 由此可以导出 景-头-君 (11-3) 式11-3表明,表示混合液组成的M点的位置必在R点与E点的联线上,且 线段RM与ME之比与混合前两溶液的质量成反比,即 E RM 反E羽 (11-4) 式(11-4)为物料街算的简捷图示方法,称为扛杆定律。根据杠杆定律,可较方便地在 图上定出M点的位置,从而确定混合液的组成。 混合物的和点与差点图11-6中的点M可表示溶液R与溶液E混合之后的数量与组成,称 为R、E两溶液的和点。反之,当从混合物M中移去一定量组成为E的液体,表示余下的 溶液组成的点R必在EM联线的延长线上,其具体位置同样可由杠杆定律确定: E/M=RM/RE (11-5) 因R点可表示余下溶液的数量和组成,故称为溶液M溶液E的差点。 11.2.2部分互溶物系的相平衡 萃取操作中的溶剂S必须与原溶液中的组分B不相溶或部分互溶。在全部操作范围内。 物系必包含以溶剂S为主的萃取相及组分B为主的萃余相。现讨论溶质A在此两相中的分 配,即当两相互成平衡时.溶质A在两相中的浓度关系。 萃取操作常按混合液中的A、B、S各组分互溶度的不同而将混合液分成两类: 第I类物系:溶质A可完全溶解于B及S中,而B、S为一对部分互溶的组分: 第Ⅱ类物系:溶质A、B可完全互溶,而B中,而B、S及A、S为两对部分互溶的组 分。 以下主要讨论第I类物系的液-液相平衡
西北大学化工原理电子教案 (R点)的溶液R kg及组成为yA、yB、B yS(E点)溶液E kg,若将两溶液互相混合,形成的混 合物总量为M kg,组成为zA、zBB、zS,此组成可用图 11-6 总的M点表示。对该体系进行物料 衡算,可得衡算式如下: 式(11-4)为物料街算的简捷图示方法,称为扛杆定律。根据杠杆定律,可较方便地在 图上定出 M 点的位置,从而确定混合液的组成。 混合物的和点与差点 图 11-6 中的点 M 可表示溶液 R 与溶液 E 混合之后的数量与组成,称 为 R、E 两溶液的和点。反之,当从混合物 M 中移去一定量组成为 E 的液体,表示余下的 溶液组成的点 R 必在 EM 联线的延长线上,其具体位置同样可由杠杆定律确定: E/M=RM/RE (11-5) 因 R 点可表示余下溶液的数量和组成,故称为溶液 M 溶液 E 的差点。 11.2.2 部分互溶物系的相平衡 萃取操作中的溶剂 S 必须与原溶液中的组分 B 不相溶或部分互溶。在全部操作范围内。 物系必包含以溶剂 S 为主的萃取相及组分 B 为主的萃余相。现讨论溶质 A 在此两相中的分 配,即当两相互成平衡时.溶质 A 在两相中的浓度关系。 萃取操作常按混合液中的 A、B、S 各组分互溶度的不同而将混合液分成两类: 第 I 类物系:溶质 A 可完全溶解于 B 及 S 中,而 B、S 为一对部分互溶的组分; 第Ⅱ类物系:溶质 A、B 可完全互溶,而 B 中,而 B、S 及 A、S 为两对部分互溶的组 分。 以下主要讨论第 I 类物系的液-液相平衡。 4

西北大学化工原理电子教案 溶解度曲线在三角形烧瓶中称取一定量的纯组分B,逐渐滴加溶剂S,不断摇动使其溶解。 由于B中仅能溶解少量溶剂S,故滴加至一定数量后混合液开始发生混浊,即出现了溶剂相。 记取所滴加的溶剂量,即为溶剂S在组分B中的饱和溶解度。此饱和溶解度可用直角三角 形相图(图11-8)中的点R表示.该点称为分层点。在上述溶液中滴加少量溶质A。溶质 的存在增加了B与S的互溶度,使混合液变成透明,此时混合液的组成在AR联线上的H 点。如再滴加数滴S,溶液再次呈现混浊,从而可算出新的分层点R1的组成,此R1必在 SH的联线上。 在溶液中文替滴加A与S,重复上述实验.可获得若干分层点R2、R3.等。同样.在 另一烧瓶中称取一定量的纯溶剂S,逐步滴加组分B可获得分层点E。再交替滴加溶质A 与B,亦可得若于分层点。将所有分层点联成一条光滑的曲线,称为溶解度曲线。因B、S 的互溶度与温度有关,上述全部实验均须在恒定温度下进行。 平衡联结线利用所获得的溶解度曲线。可以方便地确定溶质A在互成平衡的两液相中的 组成关系。现取组分B与溶剂S的双组分溶液,其组成以图11-9中的M1点表示,该溶液 必分为两层,其组成分别为E1和R1。 在此混合液中滴加少量溶质A。混合液的组 成将沿联线AM1移至点M2。 充分摇动,使溶质A在两相中的组成达到 平衡。静置分层后.取两相试样进行分析.其 11 R 1 组成分别在点E2、R2。互成平衡的两相称为共 H 扼相,E2、R2的联线称为平衡联结线,M2点 必在此平衡联结线上。 图11-8溶解度曲线 在上述两相混合液中逐次加入溶质A,重复上述实验,可得若干条平衡联结线,每一条 平衡联结线的两端为互成平衡的共扼相。 因11-9中溶解度曲线将三角形相图分成两个区。该曲线与底边R1EI所围的区域为分层 区或两相区,曲线以外是均相区。若某三组分物系的组成位于两相区内的M点,该混合液可 分为互成平衡的共扼相R及E,故溶解度曲线以内是萃取过程的可操作范围。 同一曲系的平衡联结线的倾斜方向一般相同。少数物系,在不同浓度范围内平衡联结线 的倾斜方向不同,图11-10所示的吡啶一氯苯一水系统即为一例。 5
西北大学化工原理电子教案 溶解度曲线 在三角形烧瓶中称取一定量的纯组分 B,逐渐滴加溶剂 S,不断摇动使其溶解。 由于 B 中仅能溶解少量溶剂 S,故滴加至一定数量后混合液开始发生混浊,即出现了溶剂相。 记取所滴加的溶剂量,即为溶剂 S 在组分 B 中的饱和溶解度。此饱和溶解度可用直角三角 形相图(图 11-8)中的点 R 表示.该点称为分层点。在上述溶液中滴加少量溶质 A。溶质 的存在增加了 B 与 S 的互溶度,使混合液变成透明,此时混合液的组成在 AR 联线上的 H 点。如再滴加数滴 S,溶液再次呈现混浊,从而可算出新的分层点 R1 的组成,此 R1 必在 SH 的联线上。 在溶液中文替滴加 A 与 S,重复上述实验.可获得若干分层点 R2、R3……等。同样.在 另一烧瓶中称取一定量的纯溶剂 S,逐步滴加组分 B 可获得分层点 E。再交替滴加溶质 A 与 B,亦可得若于分层点。将所有分层点联成一条光滑的曲线,称为溶解度曲线。因 B、S 的互溶度与温度有关,上述全部实验均须在恒定温度下进行。 平衡联结线 利用所获得的溶解度曲线。可以方便地确定溶质 A 在互成平衡的两液相中的 组成关系。现取组分 B 与溶剂 S 的双组分溶液,其组成以图 11-9 中的 M1 点表示,该溶液 必分为两层,其组成分别为 E1 和 R1。 在此混合液中滴加少量溶质 A。混合液的组 成将沿联线 AM1 移至点 M2。 充分摇动,使溶质 A 在两相中的组成达到 平衡。静置分层后.取两相试样进行分析.其 组成分别在点 E2、R2。互成平衡的两相称为共 扼相,E2、R2 的联线称为平衡联结线,M2 点 必在此平衡联结线上。 在上述两相混合液中逐次加入溶质 A,重复上述实验,可得若干条平衡联结线,每一条 平衡联结线的两端为互成平衡的共扼相。 因 11-9 中溶解度曲线将三角形相图分成两个区。该曲线与底边 R1EI 所围的区域为分层 区或两相区,曲线以外是均相区。若某三组分物系的组成位于两相区内的 M 点,该混合液可 分为互成平衡的共扼相 R 及 E,故溶解度曲线以内是萃取过程的可操作范围。 同一曲系的平衡联结线的倾斜方向一般相同。少数物系,在不同浓度范围内平衡联结线 的倾斜方向不同,图 11-10 所示的吡啶-氯苯-水系统即为一例。 5