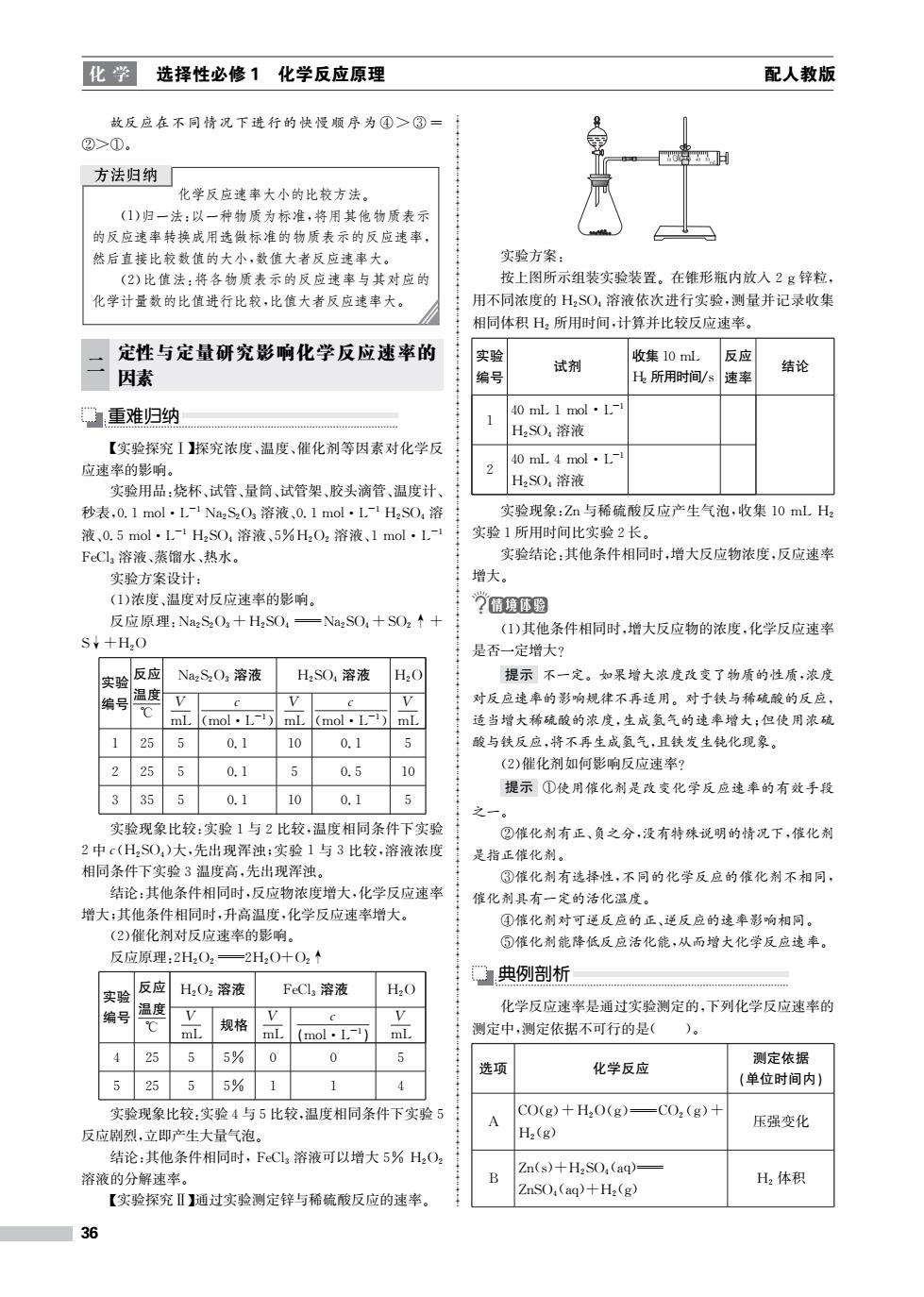
化学 选择性必修1化学反应原理 配人教版 故反应在不同情况下进行的快慢顺序为④>③= ②>①。 方法归纳 化学反应速率大小的比较方法。 (1)归一法:以一种物质为标准,将用其他物质表示 的反应速率转换成用选做标准的物质表示的反应速率, 然后直接比较数值的大小,数值大者反应速率大。 实验方案: (2)比值法:将各物质表示的反应速率与其对应的 按上图所示组装实验装置。在锥形瓶内放入2g锌粒, 化学计量数的比值进行比较,比值大者反应速率大。 用不同浓度的H2SO,溶液依次进行实验,测量并记录收集 相同体积H2所用时间,计算并比较反应速率。 定性与定量研究影响化学反应速率的 实验 收集10mL 反应 因素 试剂 结论 编号 H所用时间/s 速率 重难归纳 40ml.1mol·L-l H2SO,溶液 【实验探究I探究浓度、温度、催化剂等因素对化学反 40 ml.4 mol.L- 应速率的影响。 实验用品:烧杯、试管、量筒、试管架、胶头滴管、温度计、 H2SO,溶液 秒表,0.1mol·L1Na2SzO3溶液、0.1mol·L1H2SO,溶 实验现象:Zn与稀硫酸反应产生气泡,收集10mLH 液、0.5mol·L-1H2S04溶液、5%HzO2溶液、1mol·L-1 实验1所用时间比实验2长。 FeCl溶液、蒸馏水、热水。 实验结论:其他条件相同时,增大反应物浓度,反应速率 实验方案设计: 增大。 (1)浓度、温度对反应速率的影响。 ?情境体验 反应原理:Na2S2O3十H2SO4 Na2SO4+SO2↑+ (1)其他条件相同时,增大反应物的浓度,化学反应速率 S¥+H2O 是否一定增大? 实验/反应 Na2SzO3溶液 H2SO,溶液 H2O 提示不一定。如果增大浓度改变了物质的性质,浓度 温度 V C C V 对反应速率的影响规律不再适用。对于铁与稀硫酸的反应, ℃ mL (mol .L1) mL (mol·L-) mL 适当增大稀硫酸的浓度,生成氢气的速率增大:但使用浓硫 25 5 0.1 10 0.1 5 酸与铁反应,将不再生成氢气,且铁发生钝化现象。 2 25 5 0.1 0.5 10 (2)催化剂如何影响反应速率? 提示①使用催化剂是改变化学反应速率的有效手段 35 5 0.1 10 0.1 实验现象比较:实验1与2比较,温度相同条件下实验 ②催化剂有正、负之分,没有特殊说明的情况下,催化剂 2中c(HzSO)大,先出现浑浊:实验1与3比较,溶液浓度 是指正催化剂。 相同条件下实验3温度高,先出现浑浊。 ③催化剂有选择性,不同的化学反应的催化剂不相同, 结论:其他条件相同时,反应物浓度增大,化学反应速率 催化剂具有一定的活化温度。 增大:其他条件相同时,升高温度,化学反应速率增大。 ④催化剂对可逆反应的正、逆反应的速率影响相同。 (2)催化剂对反应速率的影响。 ⑤催化剂能降低反应活化能,从而增大化学反应速率。 反应原理:2H2O2 =2H2O+O2↑ 典例剖析 反应 实验 H2O2溶液 FeCl,溶液 H2O 化学反应速率是通过实验测定的,下列化学反应速率的 编号 温度 ℃ mL 规格 mL (mol·L-1) mL 测定中,测定依据不可行的是( )。 4 25 5 5% 0 0 5 测定依据 选项 化学反应 25 5 5% 1 4 (单位时间内)】 实验现象比较:实验4与5比较,温度相同条件下实验5 CO(g)十H2O(g)= -CO2(g) A 压强变化 反应剧烈,立即产生大量气泡。 H2(g) 结论:其他条件相同时,FCl3溶液可以增大5%H2O2 Zn(s)+H2SO (aq)= 溶液的分解速率。 B H2体积 ZnSO(ag)+H2 (g) 【实验探究Ⅱ】通过实验测定锌与稀硫酸反应的速率。 36
化 学 选择性必修1 化学反应原理 配人教版 故反应在不同情况下进行的快慢顺序为 ④ > ③ = ②>①。 化学反应速率大小的比较方法。 (1)归一法:以一种物质为标准,将用其他物质表示 的反应速率转换成用选做标准的物质表示的反应速率, 然后直接比较数值的大小,数值大者反应速率大。 (2)比值法:将各物质表示的反应速率与其对应的 化学计量数的比值进行比较,比值大者反应速率大。 二 定性与定量研究影响化学反应速率的 因素 重难归纳 【实验探究Ⅰ】探究浓度、温度、催化剂等因素对化学反 应速率的影响。 实验用品:烧杯、试管、量筒、试管架、胶头滴管、温度计、 秒表,0.1mol·L-1Na2S2O3 溶液、0.1mol·L-1 H2SO4 溶 液、0.5mol·L-1 H2SO4 溶液、5%H2O2 溶液、1mol·L-1 FeCl3 溶液、蒸馏水、热水。 实验方案设计: (1)浓度、温度对反应速率的影响。 反应原理:Na2S2O3+H2SO4 Na2SO4+SO2↑+ S↓+H2O 实验 编号 反应 温度 ℃ Na2S2O3 溶液 H2SO4 溶液 H2O V mL c (mol·L-1) V mL c (mol·L-1) V mL 1 25 5 0.1 10 0.1 5 2 25 5 0.1 5 0.5 10 3 35 5 0.1 10 0.1 5 实验现象比较:实验1与2比较,温度相同条件下实验 2中c(H2SO4)大,先出现浑浊;实验1与3比较,溶液浓度 相同条件下实验3温度高,先出现浑浊。 结论:其他条件相同时,反应物浓度增大,化学反应速率 增大;其他条件相同时,升高温度,化学反应速率增大。 (2)催化剂对反应速率的影响。 反应原理:2H2O2 2H2O+O2↑ 实验 编号 反应 温度 ℃ H2O2 溶液 FeCl3 溶液 H2O V mL 规格 V mL c (mol·L-1) V mL 4 25 5 5% 0 0 5 5 25 5 5% 1 1 4 实验现象比较:实验4与5比较,温度相同条件下实验5 反应剧烈,立即产生大量气泡。 结论:其他条件相同时,FeCl3 溶液可以增大5% H2O2 溶液的分解速率。 【实验探究Ⅱ】通过实验测定锌与稀硫酸反应的速率。 实验方案: 按上图所示组装实验装置。在锥形瓶内放入2g锌粒, 用不同浓度的 H2SO4 溶液依次进行实验,测量并记录收集 相同体积 H2 所用时间,计算并比较反应速率。 实验 编号 试剂 收集10mL H2 所用时间/s 反应 速率 结论 1 40mL1mol·L-1 H2SO4 溶液 2 40mL4mol·L-1 H2SO4 溶液 实验现象:Zn与稀硫酸反应产生气泡,收集10mLH2 实验1所用时间比实验2长。 实验结论:其他条件相同时,增大反应物浓度,反应速率 增大。 (1)其他条件相同时,增大反应物的浓度,化学反应速率 是否一定增大? 提示 不一定。如果增大浓度改变了物质的性质,浓度 对反应速率的影响规律不再适用。对于铁与稀硫酸的反应, 适当增大稀硫酸的浓度,生成氢气的速率增大;但使用浓硫 酸与铁反应,将不再生成氢气,且铁发生钝化现象。 (2)催化剂如何影响反应速率? 提示 ①使用催化剂是改变化学反应速率的有效手段 之一。 ②催化剂有正、负之分,没有特殊说明的情况下,催化剂 是指正催化剂。 ③催化剂有选择性,不同的化学反应的催化剂不相同, 催化剂具有一定的活化温度。 ④催化剂对可逆反应的正、逆反应的速率影响相同。 ⑤催化剂能降低反应活化能,从而增大化学反应速率。 典例剖析 化学反应速率是通过实验测定的,下列化学反应速率的 测定中,测定依据不可行的是( )。 选项 化学反应 测定依据 (单位时间内) A CO(g)+H2O(g)CO2(g)+ H2(g) 压强变化 B Zn(s)+H2SO4(aq) ZnSO4(aq)+H2(g) H2 体积 36

第二章化学反应速率与化学平衡 续表 答案AD 测定依据 选项 解析A项中装置不能用长颈漏斗,D项中装置产生的 化学反应 (单位时间内) CO2会被饱和Na2CO3溶液吸收。 C 2NO2(g)==N2O,(g) 颜色深浅 三 影响化学反应速率的外界因素 Ca(OH)2(ag)+Na2COs(ag) D 沉淀质量 重难归纳 CaCO(s)+2NaOH(ag) 1.外界因素对化学反应速率的影响。 答案A 解析A项,该反应是气体分子数不变的反应,反应前 影响因素 影响结果 后压强不变:B项,单位时间内H2体积变化大,速率大:C (其他条件不变】 项,2NO2=一N2O,NO2是红棕色气体,N2O4是无色气 体,可以用单位时间内气体颜色的变化来衡量反应的快慢: 浓度为常数,一般情况下,增大反应 反应物为固体或 D项,单位时间内产生的沉淀的质量越多,速率越大。 物的量,反应速率不变(改变固体物质 液体纯物质 【拓展延伸】改变固体或液体纯物质的用量对化学反应 浓 的表面积会影响反应速率) 度 速率有何影响? 答案对于固体或液体纯物质,一般情况下其浓度可视 反应物为气 增大反应物的浓度,化学反应速率 为常数,因此改变固体或液体纯物质的用量对化学反应速率 体或溶液 增大 无影响,但固体物质表面积的大小会影响化学反应速率。 般来说,固体的颗粒越细,表面积越大,反应速率就越大。 升高温度 化学反应速率增大 学以致用 对于有气体参加的化学反应,化学反 增大压强(减小 1.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四 应速率增大:对于没有气体参加的化 容器的容积) 位同学分别设计了如下实验,其中不合理的是()。 学反应,影响不大 A将大小、形状相同的镁条和铝条与相同浓度的盐酸 反应时,两者速率一样大 使用催化剂 化学反应速率增大 B.在相同条件下,将等质量的大理石块和大理石粉末 与相同浓度的盐酸反应,大理石粉末反应快 2.压强对化学反应速率的影响。 C.将浓硝酸分别放在冷暗处和强光照射下,发现光照 对于有气体参加的化学反应,通过改变反应容器的容积而 可以加快浓硝酸的分解 导致压强变化,相当于改变了反应物的浓度(如图所示),反应速 D.在两支试管中分别加人相同质量的氯酸钾,向其中 率会发生改变。 一支试管中再加入少量二氧化锰,同时加热,加入少量二氧 化锰的试管中产生氧气快 答案A 解析A项中反应物不同,相同条件下反应速率不同, 金属性较强的铁与同浓度盐酸反应的速率较大。 当其他条件不变时,增大压强(减小反应容器的容积), 2.(双选)下列都是根据气体产物体积(一定时间内)测 反应速率增大;减小压强(增大反应容器的容积),反应速率 定反应速率的装置图,不能达到目的的是( )。 减小。 H2O,溶液 改变压强,对化学反应速率的影响的根本原因是引起浓度 改变。所以在讨论压强对反应速率的影响时,应区分引起压强 H 改变的原因。压强对化学反应速率的影响有如下几种情况。 大理石 和盐酸 (1)对于没有气体参与的化学反应,由于改变压强后,反 应物浓度变化很小,可忽略不计,因此一般认为对化学反应 -MnO 速率无影响。 B (2)对于有气体参与的化学反应,有以下几种情况 硫酸 盐酸 ①恒温时,减小容积引患压强增大引起反应物浓度增大 引起反应速率增大。 ②恒温时,对于恒容密闭容器: Na2CO3饱和NaHCO CaCO3饱和Na2CO a充入气体反应物引起气体反应物浓度增大(压强也增 溶液 溶液 D 大引起反应速率增大。 37
第二章 化学反应速率与化学平衡 续表 选项 化学反应 测定依据 (单位时间内) C 2NO2(g)N2O4(g) 颜色深浅 D Ca(OH)2(aq)+Na2CO3(aq) CaCO3(s)+2NaOH(aq) 沉淀质量 答案 A 解析 A项,该反应是气体分子数不变的反应,反应前 后压强不变;B项,单位时间内 H2 体积变化大,速率大;C 项,2NO2 N2O4,NO2 是红棕色气体,N2O4 是无色气 体,可以用单位时间内气体颜色的变化来衡量反应的快慢; D项,单位时间内产生的沉淀的质量越多,速率越大。 【拓展延伸】改变固体或液体纯物质的用量对化学反应 速率有何影响? 答案 对于固体或液体纯物质,一般情况下其浓度可视 为常数,因此改变固体或液体纯物质的用量对化学反应速率 无影响,但固体物质表面积的大小会影响化学反应速率。一 般来说,固体的颗粒越细,表面积越大,反应速率就越大。 学以致用 1.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四 位同学分别设计了如下实验,其中不合理的是( )。 A.将大小、形状相同的镁条和铝条与相同浓度的盐酸 反应时,两者速率一样大 B.在相同条件下,将等质量的大理石块和大理石粉末 与相同浓度的盐酸反应,大理石粉末反应快 C.将浓硝酸分别放在冷暗处和强光照射下,发现光照 可以加快浓硝酸的分解 D.在两支试管中分别加入相同质量的氯酸钾,向其中 一支试管中再加入少量二氧化锰,同时加热,加入少量二氧 化锰的试管中产生氧气快 答案 A 解析 A项中反应物不同,相同条件下反应速率不同, 金属性较强的镁与同浓度盐酸反应的速率较大。 2.(双选)下列都是根据气体产物体积(一定时间内)测 定反应速率的装置图,不能达到目的的是( )。 答案 AD 解析 A项中装置不能用长颈漏斗,D项中装置产生的 CO2 会被饱和 Na2CO3 溶液吸收。 三 影响化学反应速率的外界因素 重难归纳 1.外界因素对化学反应速率的影响。 影响因素 (其他条件不变) 影响结果 浓 度 反应物为固体或 液体纯物质 浓度为常数,一般情况下,增大反应 物的量,反应速率不变(改变固体物质 的表面积会影响反应速率) 反应物为气 体或溶液 增大反应物的浓度,化学反应速率 增大 升高温度 化学反应速率增大 增大压强(减小 容器的容积) 对于有气体参加的化学反应,化学反 应速率增大;对于没有气体参加的化 学反应,影响不大 使用催化剂 化学反应速率增大 2.压强对化学反应速率的影响。 对于有气体参加的化学反应,通过改变反应容器的容积而 导致压强变化,相当于改变了反应物的浓度(如图所示),反应速 率会发生改变。 当其他条件不变时,增大压强(减小反应容器的容积), 反应速率增大;减小压强(增大反应容器的容积),反应速率 减小。 改变压强,对化学反应速率的影响的根本原因是引起浓度 改变。所以在讨论压强对反应速率的影响时,应区分引起压强 改变的原因。压强对化学反应速率的影响有如下几种情况。 (1)对于没有气体参与的化学反应,由于改变压强后,反 应物浓度变化很小,可忽略不计,因此一般认为对化学反应 速率无影响。 (2)对于有气体参与的化学反应,有以下几种情况。 ①恒温时,减小容积 引起 →压强增大 引起 →反应物浓度增大 引起 →反应速率增大。 ②恒温时,对于恒容密闭容器: a.充入气体反应物 引起 →气体反应物浓度增大(压强也增 大) 引起 →反应速率增大。 37

化学 选择性必修1化学反应原理 配人教版 6.充入“惰性气体引总压强增大一反应物浓度未 积不变,充入N,使体系压强增大 ④保持压强不变,充入 改变→反应速率不变。 N2使容器容积变大 ③恒温、恒压时: A.①④ B.②③ C.①③ D.②④ 充人“惰性气体引起容积增大引起气体反应物浓度减 答案C 小引起反应速率减小。 解析本题考查的是压强对化学反应速率的影响。C 方法技巧「 为固体反应物,增加其用量,对化学反应速率几乎没有影响: 容器容积缩小一半,相当于压强增大一倍,浓度增大,化学反 分析压强改变对化学反应速率的影响时, 应速率增大:容积不变,充入N2,体系总压强增大,但反应混 关键看气体反应物浓度是否有变化:若气体反应物浓度 合物的浓度并未改变,化学反应速率基本不变:压强不变,充 有变化,化学反应速率一定改变:若气体反应物浓度无 入N2,使容器的容积增大,总压强不变,但反应混合物的浓 变化,化学反应速率不改变。同时要注意通常所说的增 度变小,化学反应速率减小。 大压强是指减小反应容器容积。 【拓展延伸】对于C(s)十H2O(g)=CO(g)十H2(g)反 应,写出恒容条件下能增大该反应速率的两条可行措施。 答案①增大H2O(g)的浓度,②升高温度。 3.理论解释 有效碰撞理论。 学以致用 增大反应 分子碰撞频 升高反应 1.有关碰撞理论,下列说法不正确的是()。 物的浓度 率增大 物的温度 A.具有足够能量的分子(活化分子)相互碰撞就一定能 发生化学反应 单位时间内、单 单位体积内活 单位体积内 B.增大反应物的浓度,单位体积内活化分子数增加,有 位体积内有效碰 活化分子百 化分子数增加 效碰撞的次数增加,化学反应速率增大 撞次数增多 分数增加 C.升高温度,活化分子百分数增加,有效碰撞的次数增 加,化学反应速率增大 增大气体压强 增大化学反应速率 使用催化剂 D.催化剂能降低反应的活化能,增加活化分子百分数, 有效碰撞的次数增加,化学反应速率增大 学情境体验 答案A 在影响化学反应速率的因素中,哪些因素能提高活化分 解析活化分子发生有效碰撞才能发生化学反应,如果 子百分数? 不是有效碰撞,则不能发生反应,A项错误:增大反应物的浓 提示升高温度和加入催化剂。升高温度,更多的反应 度,单位体积内活化分子数增加,有效碰撞次数增加,化学反 物分子能量升高而成为活化分子,活化分子百分数增大:使 应速率增大,B项正确:升高温度,活化分子的百分数增加, 用催化剂,降低了反应的活化能,更多的反应物普通分子成 从而使有效碰撞次数增加,化学反应速率增大,C项正确:催 为活化分子,活化分子百分数增大。 化剂能降低反应的活化能,使活化分子的百分数增加,化学 反应速率增大,D项正确。 易错警示「 2.对于反应N2十O2=一2NO,在密闭容器中进行,下 列条件能增大其化学反应速率的是( (1)活化分子数改变,反应速率不一定改 )。 A.增大容器的容积使压强减小 变:但活化分子百分数改变,则反应速率一定改变。 B.容积不变充入N2使压强增大 (2)对于可逆反应,升高温度、增大压强、加入催化 C.容积不变充入氦气使压强增大 剂既能增大正反应速率,又能增大逆反应速率。 D.使总压强不变,充入氖气 答案B 解析增大容器的容积引起浓度减小,化学反应速率减 典例剖析 小;容积不变充入N2,N2的浓度增大,化学反应速率增大; 反应C(s)十H2O(g)=CO(g)十H2(g)在一容积可变 容积不变充入氨气,各反应物的浓度并没有改变,化学反应 的密闭容器中进行,下列条件的改变对化学反应速率几乎无 速率不变:总压强不变,充入氖气,容积增大,反应物浓度减 影响的是()。 小,化学反应速率减小。 ①增加C的量 ②将容器的容积缩小一半 ③保持容 38
化 学 选择性必修1 化学反应原理 配人教版 b.充入“惰性气体” 引起 →总压强增大 →反应物浓度未 改变 →反应速率不变。 ③恒温、恒压时: 充入“惰性气体” 引起 →容积增大 引起 →气体反应物浓度减 小 引起 →反应速率减小。 分析压强改变对化学反应速率的影响时, 关键看气体反应物浓度是否有变化:若气体反应物浓度 有变化,化学反应速率一定改变;若气体反应物浓度无 变化,化学反应速率不改变。同时要注意通常所说的增 大压强是指减小反应容器容积。 3.理论解释———有效碰撞理论。 在影响化学反应速率的因素中,哪些因素能提高活化分 子百分数? 提示 升高温度和加入催化剂。升高温度,更多的反应 物分子能量升高而成为活化分子,活化分子百分数增大;使 用催化剂,降低了反应的活化能,更多的反应物普通分子成 为活化分子,活化分子百分数增大。 (1)活化分子数改变,反应速率不一定改 变;但活化分子百分数改变,则反应速率一定改变。 (2)对于可逆反应,升高温度、增大压强、加入催化 剂既能增大正反应速率,又能增大逆反应速率。 典例剖析 反应C(s)+H2O(g)CO(g)+H2(g)在一容积可变 的密闭容器中进行,下列条件的改变对化学反应速率几乎无 影响的是( )。 ①增加C的量 ②将容器的容积缩小一半 ③保持容 积不变,充入 N2 使体系压强增大 ④保持压强不变,充入 N2 使容器容积变大 A.①④ B.②③ C.①③ D.②④ 答案 C 解析 本题考查的是压强对化学反应速率的影响。C 为固体反应物,增加其用量,对化学反应速率几乎没有影响; 容器容积缩小一半,相当于压强增大一倍,浓度增大,化学反 应速率增大;容积不变,充入 N2,体系总压强增大,但反应混 合物的浓度并未改变,化学反应速率基本不变;压强不变,充 入 N2,使容器的容积增大,总压强不变,但反应混合物的浓 度变小,化学反应速率减小。 【拓展延伸】对于C(s)+H2O(g)CO(g)+H2(g)反 应,写出恒容条件下能增大该反应速率的两条可行措施。 答案 ①增大 H2O(g)的浓度,②升高温度。 学以致用 1.有关碰撞理论,下列说法不正确的是( )。 A.具有足够能量的分子(活化分子)相互碰撞就一定能 发生化学反应 B.增大反应物的浓度,单位体积内活化分子数增加,有 效碰撞的次数增加,化学反应速率增大 C.升高温度,活化分子百分数增加,有效碰撞的次数增 加,化学反应速率增大 D.催化剂能降低反应的活化能,增加活化分子百分数, 有效碰撞的次数增加,化学反应速率增大 答案 A 解析 活化分子发生有效碰撞才能发生化学反应,如果 不是有效碰撞,则不能发生反应,A项错误;增大反应物的浓 度,单位体积内活化分子数增加,有效碰撞次数增加,化学反 应速率增大,B项正确;升高温度,活化分子的百分数增加, 从而使有效碰撞次数增加,化学反应速率增大,C项正确;催 化剂能降低反应的活化能,使活化分子的百分数增加,化学 反应速率增大,D项正确。 2.对于反应 N2+O2 2NO,在密闭容器中进行,下 列条件能增大其化学反应速率的是( )。 A.增大容器的容积使压强减小 B.容积不变充入 N2 使压强增大 C.容积不变充入氦气使压强增大 D.使总压强不变,充入氖气 答案 B 解析 增大容器的容积引起浓度减小,化学反应速率减 小;容积不变充入 N2,N2 的浓度增大,化学反应速率增大; 容积不变充入氦气,各反应物的浓度并没有改变,化学反应 速率不变;总压强不变,充入氖气,容积增大,反应物浓度减 小,化学反应速率减小。 38

第二章化学反应速率与化学平衡 随堂训练 L.下列对化学反应速率的理解正确的是()。 个容器中合成氨的反应速率的大小关系为()。 A.化学反应速率表示的是化学反应进行的程度 A.U甲>U乙>v丙 B.vz>U甲>V丙 B.化学反应速率可以用单位时间内反应物浓度的变化来 C.V甲>V丙>UZ D.V甲=Uz=U丙 表示 答案B C.化学反应速率可以用任何一种反应物或生成物的浓度 解析把用三种不同物质表示的反应速率换算成用同 变化来表示 种物质来表示,根据反应N2十3H2=一2NH可知, D.化学反应速率可以是正值,也可以是负值 答案B p(N2)=3v,(H,)=1molL1·min1、v2(N2)= 解析化学反应速率表示化学反应进行的快慢程度,不表 示反应进行的程度,A项错误;化学反应速率可以用单位 2mol,L1·min-1v%(N2)=乞v%(NH,)= 时间内反应物浓度的减少来表示,也可以用单位时间内生 0.5mol·L1·min1,可比较得出z>v甲>v两。 成物浓度的增加来表示,B项正确;反应速率不能用固体 5.把下列4种X溶液,分别加入4个盛有10mL2mol· 或液体纯物质来表示,C项错误:化学反应速率都是正值 L1盐酸的烧杯中,并加水稀释到50mL,此时X与盐酸 而无负值,D项错误。 缓缓地进行反应,其中反应速率最大的是()。 2.某温度下,在容积固定的密闭容器中反应2N2O(g)— A20mL,3mol·1B.20mL,2mol·L 4NO2(g)+O2(g)开始进行时,c(N2O5)=0.0408mol· C.10 mL,4 mol .L D.10 mL,2 mol L- L-1.1min后,c(N2O5)=0.0300mol·L-1。则该反应 答案A 的反应速率为()。 解析因加水稀释后溶液体积相同,则X的物质的量越 A.v(N2O5)=1.8X10-4mol·L-1·s- 大,浓度就越大,A中X的物质的量最大,故化学反应速 B.(N203)=1.08X10-2mol·L-1·s- 率最大。 C.(N02)=1.8×10-mol·L-1·s-1 6某探究小组用测量硝酸与大理石反应过程中固体质量减 D.(02)=1.8X10-4mol.L-1·s-1 少的方法,研究影响反应速率的因素。c(HNO3)分别为 答案A 1.00mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗 粒两种规格,实验温度为298K、308K,每次实验硝酸用 解析o(N2O5)=- (0.0300-0.0408)mol·L-1 60s 量为25.00mL、大理石用量为10.00g。 1.8X10-4mol·L·s1=1.08×10-2mol·L-1· 请完成以下实验设计表。 实验 大理石 c(HNO3) v(N02)=2u(N203)=3.6X10-4mol.L-1·s1, T/K 编号 规格 (mol·L- 实验目的 u(0)=7,0)=9X105mol.L-1.s。 ① 298 粗颗粒 2.00 (I)实验①和②探究 3.反应4A(s)+3B(g)-→2C(g)+十D(g),经2min,B的浓 HNO。浓度对该反应速 度减少0.6mol·L1,对此反应速率的表示,正确的是 ② 率的影响: ( )。 (Ⅱ)实验①和③探究温 A.用A表示的反应速率为0.4mol·L-1·min-1 度对该反应速率的影 B.分别用A,C、D表示的反应速率其比值为3:2:1 ③ 响; C.在2min末的反应速率,用B表示是0.3mol·L-1· (Ⅲ)实验①和④探究大 min- ④ 理石规格(粗、细)对该 D.在这2min内用B表示的正反应速率逐渐减小 反应速率的影响 答案D 答案②298粗颗粒1.00 ③308粗颗粒2.00 解析因A是固态物质,不能用其浓度变化来表示速率, ④298 细颗粒2.00 A、B两项错误;C项所求的反应速率是2min内平均反应 解析实验①和②探究HNO3浓度对该反应速率的影 速率,C项错误:随着反应进行反应物的浓度减小,反应速 响,其他条件应相同而HNO3浓度不同,故实验②HNO 率减小,故2min内用B表示的正反应速率逐渐减小,D 浓度应为1.00mol·L1。实验①和③探究温度对反应 项正确。 速率的影响,除了温度不同,其他条件要保持一样。实验 4.将N2和H2的混合气体分别充入甲、乙、丙三个容器中进行 ①和④探究大理石规格(粗、细)对反应速率的影响,因此 合成氨的反应,经过一段时间后三个容器的反应速率分别为 v甲(H2)=3mol·L-1·min,vz(N2)=2mol·L-l· 要求两者大理石的规格不同,一个用粗颗粒,另一个用细 颗粒。 minl,v丙(NH)=lmol·L1·min。这段时间内三 39
第二章 化学反应速率与化学平衡 随堂训练 1.下列对化学反应速率的理解正确的是( )。 A.化学反应速率表示的是化学反应进行的程度 B.化学反应速率可以用单位时间内反应物浓度的变化来 表示 C.化学反应速率可以用任何一种反应物或生成物的浓度 变化来表示 D.化学反应速率可以是正值,也可以是负值 答案 B 解析 化学反应速率表示化学反应进行的快慢程度,不表 示反应进行的程度,A项错误;化学反应速率可以用单位 时间内反应物浓度的减少来表示,也可以用单位时间内生 成物浓度的增加来表示,B项正确;反应速率不能用固体 或液体纯物质来表示,C项错误;化学反应速率都是正值 而无负值,D项错误。 2.某温度下,在容积固定的密闭容器中反应2N2O5(g) 4NO2(g)+O2(g)开始进行时,c(N2O5)=0.0408mol· L-1。1min后,c(N2O5)=0.0300mol·L-1。则该反应 的反应速率为( )。 A.v(N2O5)=1.8×10-4 mol·L-1·s-1 B.v(N2O5)=1.08×10-2 mol·L-1·s-1 C.v(NO2)=1.8×10-4 mol·L-1·s-1 D.v(O2)=1.8×10-4 mol·L-1·s-1 答案 A 解析 v(N2O5)= - (0.0300-0.0408)mol·L-1 60s = 1.8×10-4 mol·L-1 ·s-1 =1.08×10-2 mol·L-1 · min-1, v(NO2)=2v(N2O5)=3.6×10-4 mol·L-1·s-1, v(O2)= 1 2 v(N2O5)=9×10-5 mol·L-1·s-1。 3.反应4A(s)+3B(g)2C(g)+D(g),经2min,B的浓 度减少0.6mol·L-1,对此反应速率的表示,正确的是 ( )。 A.用 A表示的反应速率为0.4mol·L-1·min-1 B.分别用 A、C、D表示的反应速率其比值为3∶2∶1 C.在2min末的反应速率,用B表示是0.3mol·L-1· min-1 D.在这2min内用B表示的正反应速率逐渐减小 答案 D 解析 因 A是固态物质,不能用其浓度变化来表示速率, A、B两项错误;C项所求的反应速率是2min内平均反应 速率,C项错误;随着反应进行反应物的浓度减小,反应速 率减小,故2min内用B表示的正反应速率逐渐减小,D 项正确。 4.将N2 和 H2 的混合气体分别充入甲、乙、丙三个容器中进行 合成氨的反应,经过一段时间后三个容器的反应速率分别为 v甲 (H2)=3mol·L-1·min-1,v乙 (N2)=2mol·L-1· min-1,v丙 (NH3)=1mol·L-1·min-1。这段时间内三 个容器中合成氨的反应速率的大小关系为( )。 A.v甲 >v乙 >v丙 B.v乙 >v甲 >v丙 C.v甲 >v丙 >v乙 D.v甲 =v乙 =v丙 答案 B 解析 把用三种不同物质表示的反应速率换算成用同一 种物质 来 表 示,根 据 反 应 N2 +3H2 2NH3 可 知, v甲 (N2)= 1 3 v甲 (H2)=1mol·L-1·min-1、v乙 (N2)= 2mol·L-1·min-1、v丙 (N2 )= 1 2 v丙 (NH3 )= 0.5mol·L-1·min-1,可比较得出v乙 >v甲 >v丙 。 5.把下列4种 X溶液,分别加入4个盛有10mL 2mol· L-1 盐酸的烧杯中,并加水稀释到50mL,此时 X与盐酸 缓缓地进行反应,其中反应速率最大的是( )。 A.20mL,3mol·L-1 B.20mL,2mol·L-1 C.10mL,4mol·L-1 D.10mL,2mol·L-1 答案 A 解析 因加水稀释后溶液体积相同,则 X的物质的量越 大,浓度就越大,A 中 X的物质的量最大,故化学反应速 率最大。 6.某探究小组用测量硝酸与大理石反应过程中固体质量减 少的方法,研究影响反应速率的因素。c(HNO3)分别为 1.00mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗 粒两种规格,实验温度为298K、308K,每次实验硝酸用 量为25.00mL、大理石用量为10.00g。 请完成以下实验设计表。 实验 编号 T/K 大理石 规格 c(HNO3) (mol·L-1) 实验目的 ① 298 粗颗粒 2.00 ② ③ ④ (Ⅰ)实验 ① 和 ② 探究 HNO3 浓度对该反应速 率的影响; (Ⅱ)实验①和③探究温 度对该反应速 率 的 影 响; (Ⅲ)实验①和④探究大 理石规格(粗、细)对该 反应速率的影响 答案 ②298 粗颗粒 1.00 ③308 粗颗粒 2.00 ④298 细颗粒 2.00 解析 实验①和②探究 HNO3 浓度对该反应速率的影 响,其他条件应相同而 HNO3 浓度不同,故实验②HNO3 浓度应为1.00mol·L-1。实验①和③探究温度对反应 速率的影响,除了温度不同,其他条件要保持一样。实验 ①和④探究大理石规格(粗、细)对反应速率的影响,因此 要求两者大理石的规格不同,一个用粗颗粒,另一个用细 颗粒。 39

化学 选择性必修1化学反应原理 配人教版 课后·训练提升 基础·巩固 4.某反应过程中的能量变化如图所示(图中E1表示无催化 剂时正反应的活化能,E,表示无催化剂时逆反应的活化 1.下列有关化学反应速率的说法正确的是( )。 能)。下列有关叙述不正确的是()。 A.用铁片与稀硫酸反应制取氢气时,改用98%的浓硫酸 能量 可增大产生氢气的速率 无催化剂 B.100mL2mol·L-1的盐酸与锌片反应,加入适量的氯 有催化剂 化钠溶液,化学反应速率不变 E C.SO2的催化氧化是一个放热的反应,所以升高温度,化 学反应速率减小 △H 生成物 D.汽车尾气中的NO与CO可以缓慢反应生成N2和 反应物 CO2,减小压强,化学反应速率减小 O 答案D 反应过程 A.该反应为吸热反应 解析A项,改用98%的浓硫酸,铁发生钝化,不产生氨 B.使用催化剂能增大该反应的化学反应速率 气:B项,加入氯化钠溶液使盐酸变稀,c(H+)减小,化学 C.催化剂能降低该反应的活化能 反应速率减小:C项,升高温度,放热反应和吸热反应的速 D.逆反应的活化能大于正反应的活化能 率都增大:D项,减小压强,有气体参加的化学反应的速率 答案D 减小。 2.在反应2A(g)十B(g)一3C(g)+5D(g)中,表示该反应 解析该反应生成物总能量比反应物总能量高,为吸热反 速率最大的是()。 应,A项正确:对照图中有无催化剂的两种情况,有催化剂 A.v(A)=2mol·L-1·min- 的活化能较低,因为催化剂能降低反应的活化能,从而增 B.(B)=0.3mol·L1·s1 大化学反应速率,B、C项正确:E1大于E2,正反应的活化 C.(C)=0.8mol·L1·s 能较大,D项错误。 D.(D)=1mol·L-1·s- 5.一定温度下,在恒容密闭容器中发生下列反应:2HⅡ(g) 答案B =一H2(g)十I2(g)。若c(H1)由0.1mol·L1降到0.07 解折(A=1nol.L1·mim1=0ol1… mol·L-1时,需要15s,那么c(HI)由0.07mol·L1降 到0.05mol·L-时,所需反应的时间()。 gB)=a3mlL1.g,写G- A等于5s B.等于10s 3 mol·L-1. C.大于10s D.小于10s ,号(D)=0.2m0lL1g,故B项表示的反应选 答案C 解析若c(HI)由0.1mol·L降到0.07mol·L 率最大。 3.一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的 时,需要15s,那么以同样的速率反应时,c(HⅡ)由 物质的量随时间变化的曲线如图所示,10s时达到化学平 0.07mol·L-1降到0.05mol·L-1,需10s,但是随反应 衡状态。则从反应开始到10s末的反应速率用X表示是 的进行,化学反应速率会逐渐减小,故所需时间大于10s, C项正确。 )。 6.在气体反应中,改变下列条件,能使反应物中活化分子数 1.5 和活化分子百分数都增大的是( )。 1.2 ①增大反应物的浓度②升高温度 ③压缩容积增大压 1.0 强④移去生成物⑤加入催化剂 0.4 A.①⑤ B.①③ 0.2 C.②⑤ D.③④⑤ 0 10 时间/s 答案C A.0.08mol·L-1·s-1 解析①增大反应物的浓度,只能增大单位体积内活化分 B.0.30mol·L-1·s1 子数:③压缩容积增大压强实际为增大反应物浓度,与① C.0.16mol.L-1.s-1 相同:④移去生成物不影响反应物的活化分子数及活化分 D.0.32mol.L-1.s-1 子百分数。 答案C 7.已知反应2NO(g)十Br2(g)=一2NOBr(g) 解折X)=-0,4-12》m0l=0.16molL-1.s1. △H=-ak·mol1(a>0),其反应历程如下: 0.5L×10s ①NO(g)+Br2(g)=一NOBr2(g)快 40
化 学 选择性必修1 化学反应原理 配人教版 课后·训练提升 基础 巩固 1.下列有关化学反应速率的说法正确的是( )。 A.用铁片与稀硫酸反应制取氢气时,改用98%的浓硫酸 可增大产生氢气的速率 B.100mL2mol·L-1 的盐酸与锌片反应,加入适量的氯 化钠溶液,化学反应速率不变 C.SO2 的催化氧化是一个放热的反应,所以升高温度,化 学反应速率减小 D.汽车尾气中的 NO 与 CO 可以缓慢反应生成 N2 和 CO2,减小压强,化学反应速率减小 答案 D 解析 A项,改用98%的浓硫酸,铁发生钝化,不产生氢 气;B项,加入氯化钠溶液使盐酸变稀,c(H+ )减小,化学 反应速率减小;C项,升高温度,放热反应和吸热反应的速 率都增大;D项,减小压强,有气体参加的化学反应的速率 减小。 2.在反应2A(g)+B(g)3C(g)+5D(g)中,表示该反应 速率最大的是( )。 A.v(A)=2mol·L-1·min-1 B.v(B)=0.3mol·L-1·s-1 C.v(C)=0.8mol·L-1·s-1 D.v(D)=1mol·L-1·s-1 答案 B 解析 1 2 v(A)=1mol·L-1·min-1= 1 60 mol·L-1· s-1,v(B)=0.3mol·L-1·s-1, 1 3 v(C)= 0.8 3 mol·L-1· s-1, 1 5 v(D)=0.2mol·L-1·s-1,故B项表示的反应速 率最大。 3.一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的 物质的量随时间变化的曲线如图所示,10s时达到化学平 衡状态。则从反应开始到10s末的反应速率用X表示是 ( )。 A.0.08mol·L-1·s-1 B.0.30mol·L-1·s-1 C.0.16mol·L-1·s-1 D.0.32mol·L-1·s-1 答案 C 解析 v(X)=- (0.4-1.2)mol 0.5L×10s =0.16mol·L-1·s-1。 4.某反应过程中的能量变化如图所示(图中E1 表示无催化 剂时正反应的活化能,E2 表示无催化剂时逆反应的活化 能)。下列有关叙述不正确的是( )。 A.该反应为吸热反应 B.使用催化剂能增大该反应的化学反应速率 C.催化剂能降低该反应的活化能 D.逆反应的活化能大于正反应的活化能 答案 D 解析 该反应生成物总能量比反应物总能量高,为吸热反 应,A项正确;对照图中有无催化剂的两种情况,有催化剂 的活化能较低,因为催化剂能降低反应的活化能,从而增 大化学反应速率,B、C项正确;E1 大于E2,正反应的活化 能较大,D项错误。 5.一定温度下,在恒容密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol·L-1 降到0.07 mol·L-1 时,需要15s,那么c(HI)由0.07mol·L-1 降 到0.05mol·L-1 时,所需反应的时间( )。 A.等于5s B.等于10s C.大于10s D.小于10s 答案 C 解析 若c(HI)由0.1mol·L-1 降到0.07mol·L-1 时,需要 15s,那 么 以 同 样 的 速 率 反 应 时,c(HI)由 0.07mol·L-1 降到0.05mol·L-1,需10s,但是随反应 的进行,化学反应速率会逐渐减小,故所需时间大于10s, C项正确。 6.在气体反应中,改变下列条件,能使反应物中活化分子数 和活化分子百分数都增大的是( )。 ①增大反应物的浓度 ②升高温度 ③压缩容积增大压 强 ④移去生成物 ⑤加入催化剂 A.①⑤ B.①③ C.②⑤ D.③④⑤ 答案 C 解析 ①增大反应物的浓度,只能增大单位体积内活化分 子数;③压缩容积增大压强实际为增大反应物浓度,与① 相同;④移去生成物不影响反应物的活化分子数及活化分 子百分数。 7.已知反应2NO(g)+Br2(g)2NOBr(g) ΔH=-akJ·mol-1(a>0),其反应历程如下: ①NO(g)+Br2(g)NOBr2(g) 快 40