
第三章 滴定分析法 概论 李丹 k沙理)大 CHANGSHA UNNVERSITY OF SCENCE TECHNOLDGY
L/O/G/O 第三章 滴定分析法 概论 李 丹
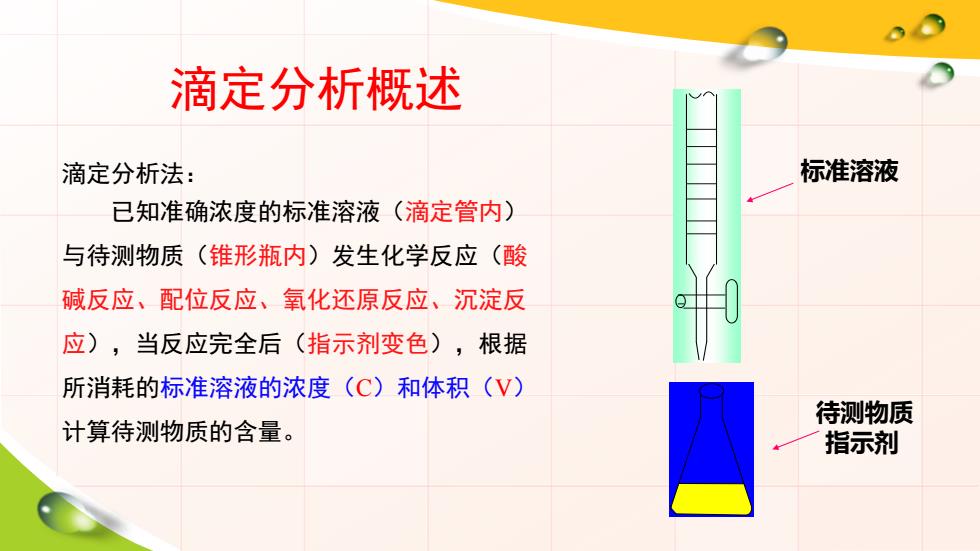
滴定分析概述 滴定分析法: 标准溶液 已知准确浓度的标准溶液(滴定管内) 与待测物质(锥形瓶内)发生化学反应(酸 碱反应、配位反应、氧化还原反应、沉淀反 应),当反应完全后(指示剂变色),根据 所消耗的标准溶液的浓度(C)和体积(V) 待测物质 计算待测物质的含量。 指示剂
滴定分析概述 滴定分析法: 已知准确浓度的标准溶液(滴定管内) 与待测物质(锥形瓶内)发生化学反应(酸 碱反应、配位反应、氧化还原反应、沉淀反 应),当反应完全后(指示剂变色),根据 所消耗的标准溶液的浓度(C)和体积(V) 计算待测物质的含量。 标准溶液 待测物质 指示剂
泉沙理)大举 基本名词 滴定分析: 滴定分析 标准溶液 滴定剂 滴定 标准溶液:已知准确浓度 (C:0.1000mol/L四位有效数字) 化学计量点(sp):反应刚好完全的那一点 滴定剂:装在滴定管内的标准溶液; 滴定终点(ep):指示剂刚好变色的那一点 滴定:装在滴定管内的标准溶液滴加 到锥形瓶里,和待测物质发生化学反 终点误差:滴定终点与化学计量点不一致 应,当反应完全后(指示剂变色), 根据所消耗的标准溶液的浓度(C) 而产生的误差(主要误差) 和体积(V)计算待测物质的含量
基本名词 化学计量点(sp):反应刚好完全的那一点 终点误差:滴定终点与化学计量点不 一致 而产生的误差(主要误差) 滴定分析 标准溶液 滴定剂 滴定 滴定终点(ep):指示剂刚好变色的那一点 滴定分析: 标准溶液:已知准确浓度 (C:0.1000 mol/L 四位有效数字) 滴定剂:装在滴定管内的标准溶液; 滴定:装在滴定管内的标准溶液滴加 到锥形瓶里,和待测物质发生化学反 应,当反应完全后(指示剂变色), 根据所消耗的标准溶液的浓度(C) 和体积(V)计算待测物质的含量
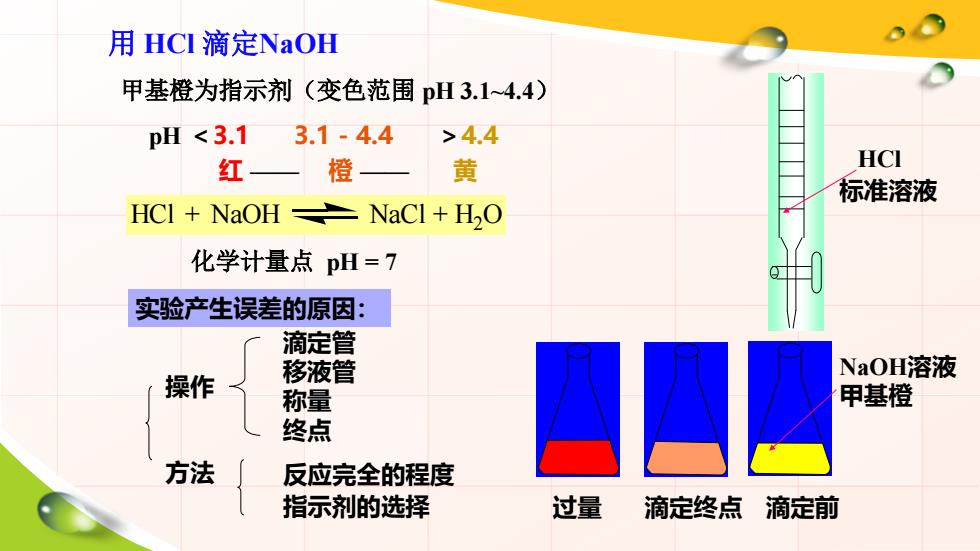
用HCI滴定NaOH 甲基橙为指示剂(变色范围pH3.14.4) pH<3.1 3.1-4.4 >4.4 红— 橙 黄 HCI 标准溶液 HCI NaOH NaCl H2O 化学计量点pH=7 实验产生误差的原因: 滴定管 操作 移液管 NaOH溶液 称量 甲基橙 终点 方法 反应完全的程度 指示剂的选择 过量 滴定终点 滴定前
用 HCl 滴定NaOH 甲基橙为指示剂(变色范围 pH 3.1~4.4) HCl + NaOH NaCl + H2 O 化学计量点 pH = 7 HCl 标准溶液 NaOH溶液 甲基橙 过量 滴定前 红 —— 橙 —— 黄 pH <3.1 3.1 - 4.4 >4.4 滴定终点 实验产生误差的原因: 操作 方法 滴定管 移液管 称量 终点 反应完全的程度 指示剂的选择

沙理工大举 滴定分析对化学反应的要求 (KMnO3,+ Na2S203)? (1)反应定量完成,反应完全,要求达99.9%以上 反应的平衡常数HAc=Ac+H中;平衡常数K, (2)有一定的化学计量关系。(化学反应方程式) 5C2042-+2Mn04+16H=10C02↑+2Mn2++8H,0 (3)反应速度快 (4)有比较简便的方法确定反应终点(合适的指示剂)
滴定分析对化学反应的要求 (1)反应定量完成,反应完全,要求达99.9%以上 反应的平衡常数 (2)有一定的化学计量关系。(化学反应方程式) (3)反应速度快 (4)有比较简便的方法确定反应终点(合适的指示剂) HAc ⇌ Ac- + H+;平衡常数 Ka 5C2O4 2-+2MnO4 ˉ +16H+ = 10CO2 ↑+2Mn2+ + 8H2O