
例:在1mol/LHSO4中,用KMnO,滴定Fe2*,求反应的条件平 衡常数?该反应能否定量完全进行? (已知:p9'aMa0w,m2为L.45K,p9'3hm2为-U68) 解:(1)Mn04+Ht+5e-=r++H0 m=5,08=1.45V Fe3++e=Fe2+ 2=1,φg=0.68V .n=5 1gK'=n(p-p2-5x1.45-0.68) =65.25 K'=1065.25 0.059 0.059 lgk=n (- =65.25>3(n1+n2)=18 .059 n(o) 3(a+b) 。 反应完全(能定量完全反应) 0.059V
, 1 1 n V 5, 1.45 θ = ϕ = , 2 2 n V 1, 0.68 θ = ϕ = 例:在1mol/L H 1mol/L H 1mol/L H 1mol/L H 1mol/L H 1mol/L H 1mol/L H 1mol/L H22SO44中,用KMnO44滴定 Fe2+2+,求反应的条件平 ,求反应的条件平 衡常数?该反应能否定量完全进行? 衡常数?该反应能否定量完全进行? (已知:ϕθθ′′ (MnO4 -/ (MnO4 -/ (MnO4 -/ (MnO4 -/ (MnO4 -/ (MnO4 -/ (MnO4 -/ (MnO4 -/Mn Mn 2+) 2+)=1.45V,ϕϕθθ′′ (Fe 3+/Fe 2+) (Fe 3+/Fe 2+) (Fe 3+/Fe 2+) (Fe 3+/Fe 2+) (Fe 3+/Fe 2+) (Fe 3+/Fe 2+) (Fe 3+/Fe 2+) (Fe 3+/Fe 2+)=0.68V) 解:(1)MnO44 - + 8H++ + 5e - = Mn2+ 2++ 4H22O Fe3+3+ + e- = Fe2+ 2+ 2+ 2+ 2+ 2+ 2+ 2+ ∴ n= 5 θ θ 1 2 n( - ) 3(a+b) 0.059V ϕ ϕ ≥ ˊ ˊ 65.25 0.059 5 1.45 - 0.68 0.059 n - lgK 1 2 = × ′ = = (ϕθ′ ϕθ′) ( ) 65.25 K′ =10 65.25 3(n n ) 18 0.059 n - lgK 1 2 1 2 ′ = = > + = (ϕθ′ ϕθ′) ∴ 反应完全(能定量完全反应 能定量完全反应)

后酒子大学 Shihezi University 四。氧化还原反应速率及影响因素 ■在氧化还原反应中,平衡常数的大小只能表示反应进行的程 度,并不能说明反应的速率。 口对于氧化还原反应,一般不能仅从平衡观点来考虑反应的可 能性,还应从反应速率方面考虑其现实性。 ■有的反应虽然从理论上判断是可以进行的,但实际上由于反 应速率太慢而可以认为并没有发生反应
四. 氧化还原反应速率及影响因素 氧化还原反应速率及影响因素 � 在氧化还原反应中,平衡常数的大小只能表示反应进行的程 在氧化还原反应中,平衡常数的大小只能表示反应进行的程 度,并不能说明反应的速率。 度,并不能说明反应的速率。 � 对于氧化还原反应,一般不能仅从平衡观点来考虑反应的可 对于氧化还原反应,一般不能仅从平衡观点来考虑反应的可 能性,还应从反应速率方面考虑其现实性。 能性,还应从反应速率方面考虑其现实性。 � 有的反应虽然从理论上判断是可以进行的,但实际上由于反 有的反应虽然从理论上判断是可以进行的,但实际上由于反 应速率太慢而可以认为并没有发生反应。 应速率太慢而可以认为并没有发生反应
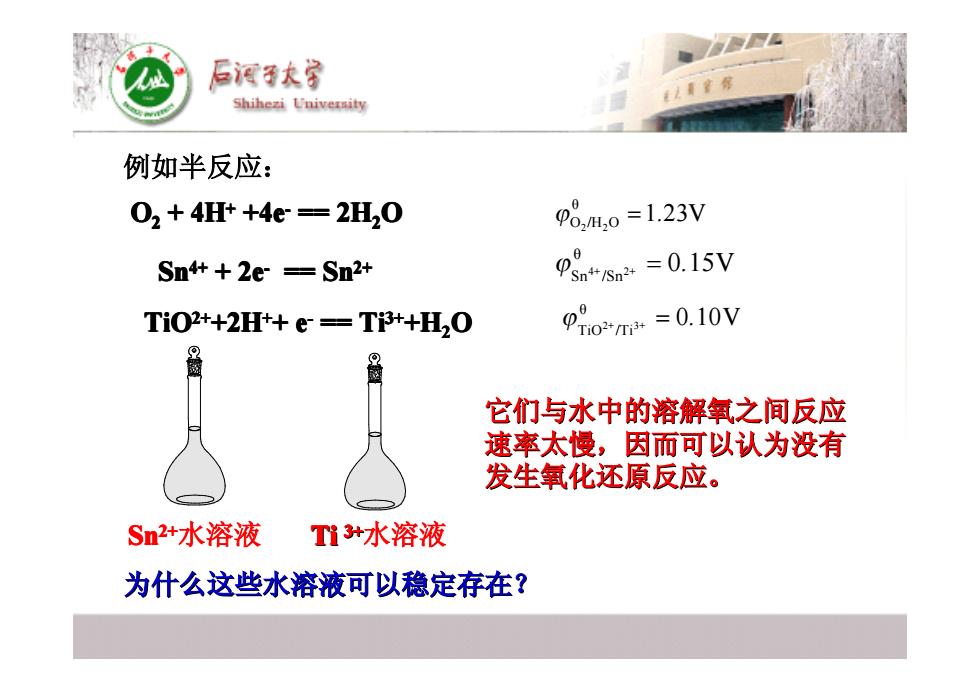
后酒子大宝 Shihezi University 例如半反应: 02+4H+4e=2H20 p8,H,0=1.23V Sn+++2e=Sn2+ =0.15V TiO2++2H++e=Ti++H,O =0.10V 它们与水中的溶解氧之间反应 速率太慢,因而可以认为没有 发生氧化还原反应。 Sn2+水溶液 Ti+水溶液 为什么这些水溶液可以稳定存在?
例如半反应: O22 + 4H++ +4e- == 2H22O O O O O O O O 2 2 θ O /H O ϕ =1 23V . Sn4+4+ + 2e- == Sn2+2+ 4+ 2+ θ Sn /Sn ϕ = 0 15V . TiO2+2++2H+++ e- == Ti3+3++H22O O O O O O O O 2+ 3+ θ TiO /Ti ϕ = 0 10V . Sn2+水溶液 Ti 3+3+水溶液 为什么这些水溶液可以稳定存在? 为什么这些水溶液可以稳定存在? 它们与水中的溶解氧之间反应 它们与水中的溶解氧之间反应 速率太慢,因而可以认为没有 速率太慢,因而可以认为没有 发生氧化还原反应。 发生氧化还原反应

后调子大学 Shihezi University 影响氧化还原反应速率的因素 >反应物浓度:反应物增加,反应速率增大,满足质量作 用定律。 >温度:温度每增高10℃,反应速率增大2一3倍。 例:KMn04滴定H2C204,需加热至75一85℃ 2Mm0,+5C,0}+16H0-0c→2Mm2++10C02+8H,0
影响氧化还原反应速率的因素 影响氧化还原反应速率的因素 � 反应物浓度: 反应物c增加, 反应速率增大,满足质量作 反应速率增大,满足质量作 用定律。 � 温度:温度每增高10℃, 反应速率增大2-3倍。 例: KMnO44滴定H22C22O44,需加热至75-85℃ 2MnO 5C O 16H 2Mn 10CO2 8H2O 2 70~80 C 2 4 + 2 4 + ⎯⎯⎯⎯→ + + − − + + �

后酒子大宝 Shihezi University > 催化剂的影响 Catalyzer,catalyzed reaction 催化剂的使用能显著改变反应的速度。催化剂的作用主要在 于改变反应历程,或降低原来反应的活化能。 例如:MnO4的自催化 Mn04-与C2O,2-在酸性溶液中即使加热反应开始时速率 仍较慢,但随着反应的进行越来越快,这是由于反应产物 Mn2+起催化作用所致
� 催化剂的影响 催化剂的使用能显著改变反应的速度。催化剂的作用主要在 催化剂的使用能显著改变反应的速度。催化剂的作用主要在 于改变反应历程,或降低原来反应的活化能。 于改变反应历程,或降低原来反应的活化能。 Catalyzer Catalyzer Catalyzer Catalyzer Catalyzer Catalyzer Catalyzer Catalyzer, catalyzed reaction , catalyzed reaction , catalyzed reaction , catalyzed reaction , catalyzed reaction , catalyzed reaction , catalyzed reaction , catalyzed reaction 例如: KMnO44的自催化 MnO 44-与C22O44 22-在酸性溶液中即使加热反应开始时速率 在酸性溶液中即使加热反应开始时速率 仍较慢,但随着反应的进行越来越快,这是由于反应产物 仍较慢,但随着反应的进行越来越快,这是由于反应产物 Mn2+2+起催化作用所致。 起催化作用所致