
7.1.3氧化还原反应平衡常数 归东理子大深 SHANDONG UNIVERSITY OF TECHNOLOGY 标准电势(条件电势) 平衡常数 Ox +ze=Red 0=0,9+ 0.059 dox 式1 21 Ox2+2e=Red, 见=%9+0.059 1g 式2 aRedz 如果p1>p2,有氧化还原反应 2201+21R2=22R1+202 K= 当反应达到平衡时,φ1=2 °+0059 ared =p+ 0.059 dOx2 21 22 21
21 标准电势(条件电势) 平衡常数 1 + 1 = Red1 Ox z e 1 1 1 Re 1 1 lg 0.059 = + d Ox a a z 2 + 2 = Red2 Ox z e 2 2 2 Re 2 2 lg 0.059 d Ox a a z = + 如果φ1 > φ2 ,有氧化还原反应 2 1 + 1 2 = 2 1 + 1O2 z O z R z R z 1 2 2 1 1 2 2 R1 z R z O z O z a a a a K = 当反应达到平衡时,φ1=φ2 2 2 1 1 2 Re 2 1 Re 1 lg 0.059 lg = + 0.059 + d Ox d Ox a a a z a z 式1 式2 7.1.3 氧化还原反应平衡常数 21

归东理王大得 SHANDONG UNIVERSITY OF TECHNOLOGY 4o9=p9-p 0 0.059 a0x2 0.059 aOxi 22 aRed2 21 aRed 310.05 -1g 220.059 1g aox1 2221 aRed2 2122 aRedi z为两电对得失电子 Z1 的最小公倍数,也即 0.059 80x2 0.059 aox 氧化还原反应实际上 g 的转移的电子数。 Z2Z1 aRedz 0.059 0.059 a a 1gK 1g K 2221 R, 平衡常数 1gk-(9z △φZ☑ →电子转移数 0.059 0.059 结论:K与△0及z有关,△0相差越大,gK越大,反应越完全
22 1 1 2 2 Red Ox Red 1 Ox 2 θ 2 θ 1 θ a a lg z 0.059 a a lg z 0.059 Δ = − = − 1 1 2 2 Red Ox 1 2 2 Red Ox 2 1 1 a a lg z z z 0.059 a a lg z z z 0.059 = − 2 1 1 1 2 2 z Red Ox 2 1 z Red Ox 2 1 a a lg z z 0.059 a a lg z z 0.059 − = 2 1 2 1 1 2 1 2 z O z R z R z O 2 1 a a a a lg z z 0.059 lgK = K z 0.059 z为两电对得失电子 的最小公倍数,也即 氧化还原反应实际上 的转移的电子数。 0.059 Δφ z = 0.059 ( φ - φ )z lgK = θ θ 2 θ 1 平衡常数 电子转移数 结论:K与Δφ θ及z有关,Δφ θ相差越大,lgK越大,反应越完全22

考虑各种副反应,则应用相应的条件电势 久连迷承大得 NDONG UNIV OGY 到条件平衡常数K' K'=(eey Ig K'l( △0 Z 2= Red2 0.059 K'更能说明氧化还原反应实际进行的程度 化学计量点时,反应进行的程度还可用氧化态与还 原态的浓度的比值来表示,这个比值是可以根据平衡常 数求导的
23 考虑各种副反应,则应用相应的条件电势带入上述公式,得 到条件平衡常数Kʹ 0.059 z ) = c c ) ( c c lg K'= lg( ′ z Ox Red z Red Ox 2 1 1 1 2 2 2 1 1 1 2 2 z Ox z Red Red Ox ) c c ) ( c c K′ = ( Kʹ更能说明氧化还原反应实际进行的程度 化学计量点时,反应进行的程度还可用氧化态与还 原态的浓度的比值来表示,这个比值是可以根据平衡常 数求导的 23

71.4化学计量点时反应进行的程度 归东理工大彩 SHANDONG UNIVERSITY OF TECHNOLOGY [例题]计算在1mol/LHCl介质中Fe3+与Sn+反应的平衡常数及 化学计量点时反应进行的程度 解:查询附录表得,1 mol/L HC1中,pF3+e2+=0.68V, p°sn4+sn2+=0.14V Sn2++2Fe3+=Sn4++2Fe2+ IgK'= g°z (0.68-0.14)×2 =18.30 0.059 0.059 1 化学计量点时 leK-lerr)le C K- Fe3 Sn- 得 =10183013=106,10转化率>99.9999%,反应很完全 /Fe3+
24 [例题] 计算在1 mol/L HCl 介质中Fe3+与Sn2+ 反应的平衡常数及 化学计量点时反应进行的程度 2+ 3+ 4+ 2+ Sn + 2Fe = Sn + 2Fe 解:查询附录表得,1 mol/L HCl 中, φ ө´ Fe3+/Fe2+ = 0.68 V, φ ө´ Sn4+/Sn2+ = 0.14 V =18.30 0.059 (0.68 - 0.14)×2 = ) c c ) ( c c lgK'= lg( 2+ 4+ 3+ 2+ Sn 2 Sn Fe Fe 化学计量点时 2+ 4+ Fe Sn c = c 2 1 3+ 2+ Fe Sn c = c 2 1 3 Fe Fe ) c c = lg( + 3 2+ 3 Fe Fe ) c c K'= ( 3+ 2+ 得 18.30/3 Fe Fe =10 c c 3+ 2+ 6.10 =10 转化率>99.9999%,反应很完全 0.059 Δφ z lgK'= θ' 7.1.4 化学计量点时反应进行的程度 24
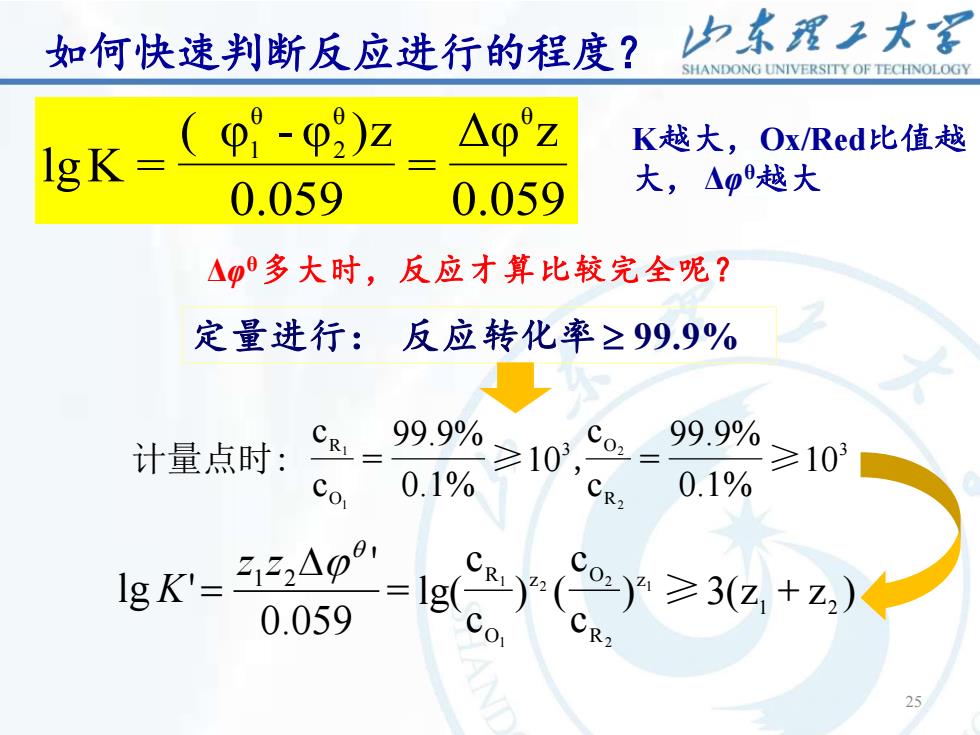
如何快速判断反应进行的程度? 中东理子大军 SHANDONG UNIVERSITY OF TECHNOLOGY 1gK=(9°-0)z △φ°z K越大,Ox/Red比值越 0.059 0.059 大,△p越大 △多大时,反应才算比较完全呢? 定量进行:反应转化率≥99.9% 计量点时:= 99.9% ≥103, 99.9% ≥103 Co, 0.1% 0.1% gK-234 0.059 -=lg( 0-y≥3(z+z)
25 如何快速判断反应进行的程度? 0.059 Δφ z = 0.059 ( φ - φ )z lgK = θ θ 2 θ 1 K越大,Ox/Red比值越 大, Δφ θ越大 Δφ θ多大时,反应才算比较完全呢? 定量进行: 反应转化率 99.9% 3 R 3 O O R 10 0.1% 99.9% = c c 10 0.1% 99.9% = c c 2 2 1 计量点时: 1 ≥ , ≥ 0.059 ' lg ' 1 2 = z z K ) 3(z + z ) c c ) ( c c = lg( 1 2 z R z O O R 1 2 2 2 1 1 ≥ 25