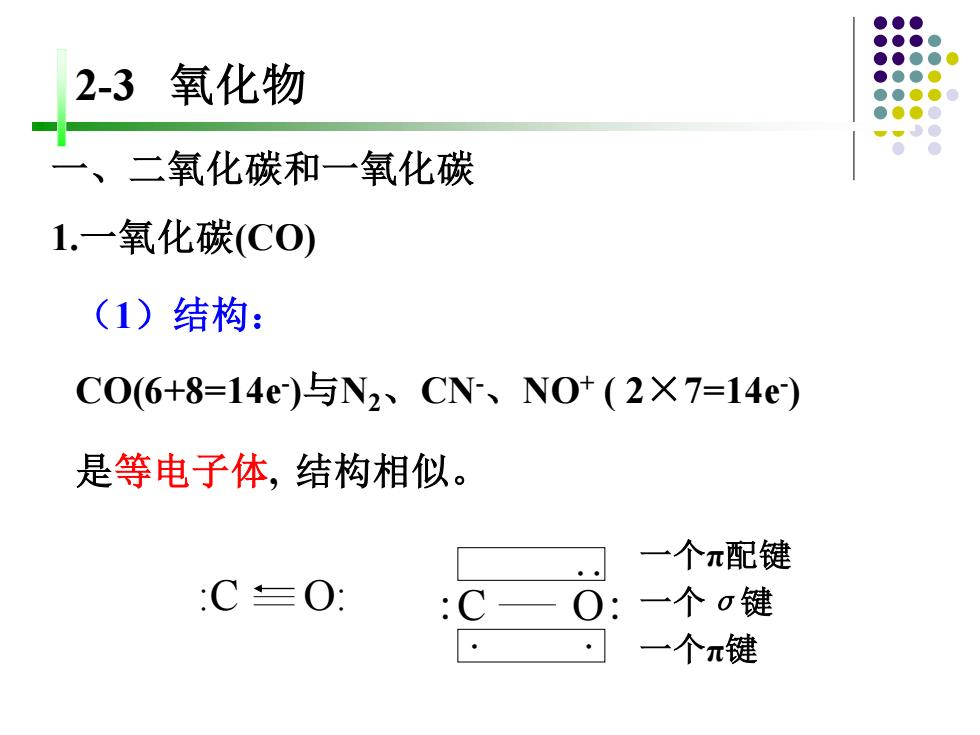
2-3氧化物 、 二氧化碳和一氧化碳 1.一氧化碳(C0) (1)结构: C06+8=14e)与N2、CN-、N0+(2×7=14e) 是等电子体,结构相似。 一个π配键 :C=O: : 0: 一个0键 一个π键
2-3 氧化物 (1)结构: CO(6+8=14e- )与N2、CN-、NO+ ( 2×7=14e- ) 是等电子体, 结构相似。 一个π配键 一个σ键 一个π键 :C O: 一、二氧化碳和一氧化碳 1.一氧化碳(CO) :C O:

CO与N2、CN、NO+互为等电子体。 N2 02s 025* 乃2pw2pz Ozpx 万2py*2p 2px CO 30 40 1π 50 2π 60 C0[1σ)22)23σ)2(4σ)2(1)45σ)21 1σ+1π+1π配键 N2 IKK(s)2 (2s)2(py,p)(2p)21 键级=(8-2)/2=3
CO与N2、CN-、NO+互为等电子体。 1 1 1 + + 配键 CO [(1) 2 (2) 2 (3) 2 (4) 2 (1) 4 (5) 2 ] N2 2s 2s ﹡ 2py 2pz 2px 2py ﹡ 2pz ﹡ 2px ﹡ CO 3 4 1 5 2 6 N2 [KK(2s) 2 (2s * ) 2 (2py , 2pz) 4 (2px) 2 ] 键级 =(8-2)/ 2 = 3

(2)C0与N2共同点 ①电偶极矩很小; ②配位作用 】(Lewis base) M←-:CO n值 CO 0.11D,H0 1.85D, NH; 1.47D,HF 1.98D 有人认为 也有人认为 88 :C=O: :C=O:
(2) CO与N2共同点 ① 电偶极矩很小; ② 配位作用(Lewis base) M ←:CO μ值 CO 0.11 D, H2O 1.85 D, NH3 1.47 D , HF 1.98 D 有人认为 也有人认为 δ - δ + δ + δ - : C O : :C O :

(3)化性-强还原性、强配位性 ①强还原性 R.T.,C0对02、O3、H202皆很稳定,日光下也无作 用,但高温下,C0在空气中燃烧生成CO2。 Fe2O3()+3CO 2 2Fe+3CO21 NaAc(aq) PdCl(ag)+2COg)+H2O Pd↓+CO2↑+2HCI 检定CO 灰黑色 Co+S △ cos C0+CL,光照→COCL
(3)化性- 强还原性、强配位性 R.T.,CO对O2、O3、H2O2皆很稳定,日光下也无作 用,但高温下,CO在空气中燃烧生成CO2。 Fe2O3(s) +3CO 2Fe + 3CO2↑ PdCl2(aq) + 2CO(g) + H2O Pd↓+ CO2↑+ 2HCl 检定CO 灰黑色 NaAc aq ( ) ① 强还原性 CO + S COS 2 光照 CO+Cl2 ⎯⎯→COCl

② 强配位性 生成羰基配合物 Me) + x CO(g M(CO) M x值 颜色、状态 M(CO)构型 Ni 4 无色液体 正四面体 Fe,Ru,Os 5 Fe)黄色液体 三角双锥体 Cr,Mo,W,V 6 (C)晶体真空中升华 正八面体 Ni NiCO)4A→Ni+CO Fe+xCO(g) RT→Fe(CO)为 提纯金属 Co HCo(CO)
② 强配位性 M(s) + x CO(g) = M(CO)x M x值 颜色、状态 M(CO)x构型 Ni 4 无色液体 正四面体 Fe, Ru, Os 5 (Fe)黄色液体 三角双锥体 Cr, Mo, W, V 6 (Cr)晶体真空中升华 正八面体 Co HCo(CO) Fe x CO(g) Fe(CO) N i Ni(CO) N i CO 4 5 R.T. 4 + ⎯⎯→ ⎯→ + 提纯金属 生成羰基配合物