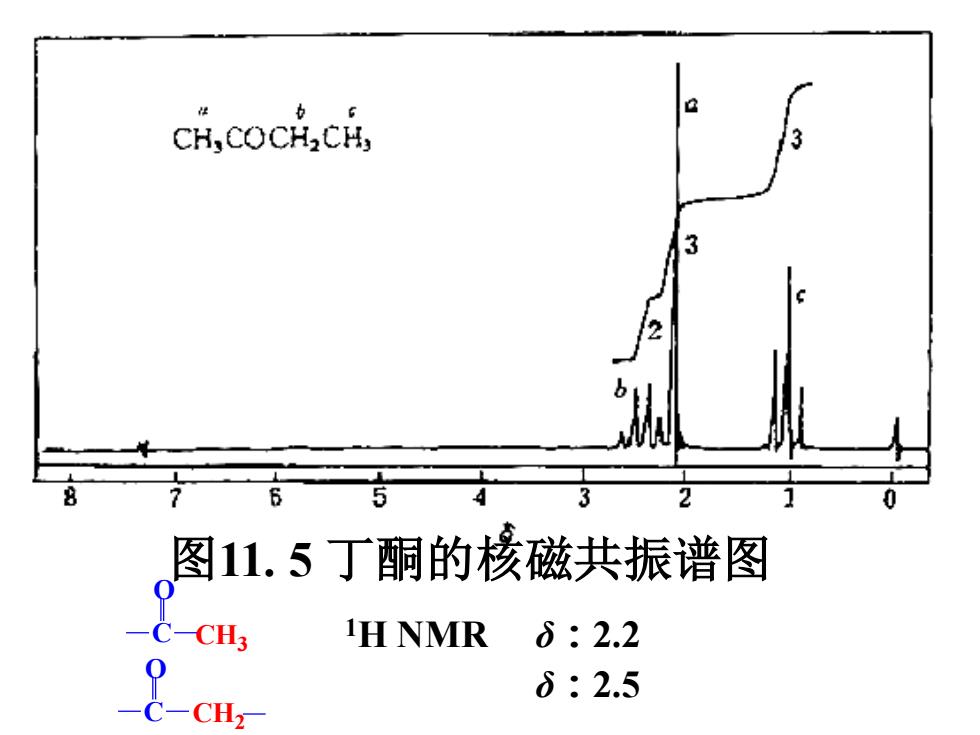
a CH,COCH2CH, 3 2 图11.5丁酮的核磁共振谱图 0 C-CH3 iH NMR δ:2.2 8-( δ:2.5
CH3 C CH2 O C O 1H NMR δ:2.2 δ:2.5 图11. 5 丁酮的核磁共振谱图
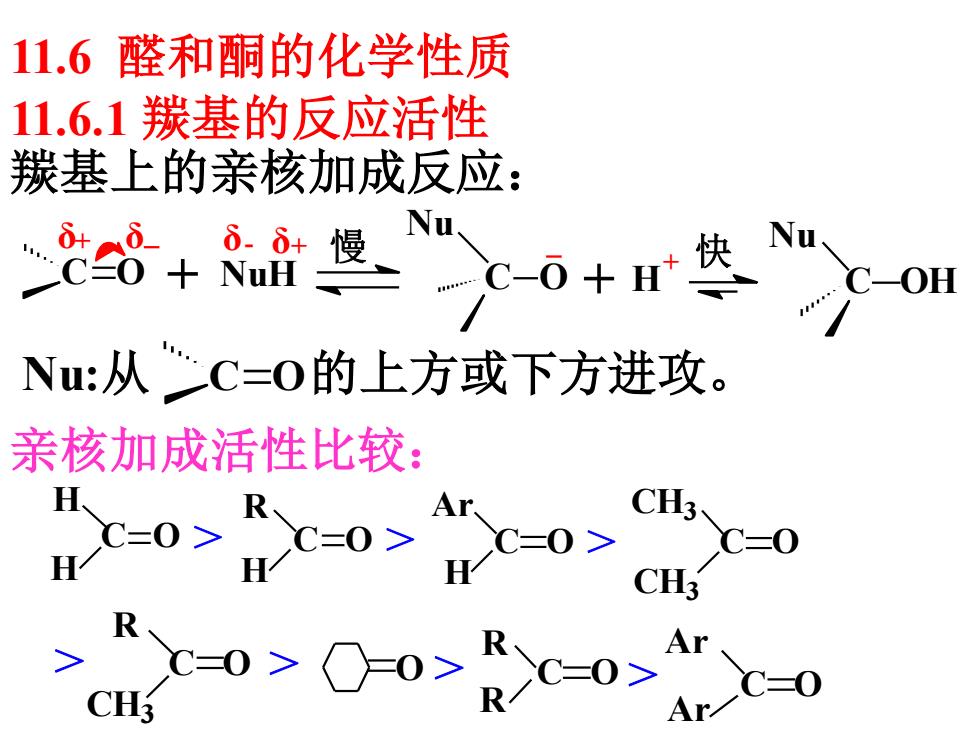
11.6醛和酮的化学性质 11.6.1羰基的反应活性 羰基上的亲核加成反应: 8+ ò.+慢 Nu +H快u Nu:从C=O的上方或下方进攻。 亲核加成活性比较: =0>c0>=0 cC-0 c C=0 CH C=0
11.6.1 羰基的反应活性 羰基上的亲核加成反应: Nu:从 的上方或下方进攻。 11.6 醛和酮的化学性质 NuH 慢 Nu C O + 快 Nu C OH δ δ + - + C O + H δ+ δ C O H H R H Ar H CH3 CH3 C O > C O > C O > C O R CH3 R R Ar Ar C O C O C O > > O > > 亲核加成活性比较:
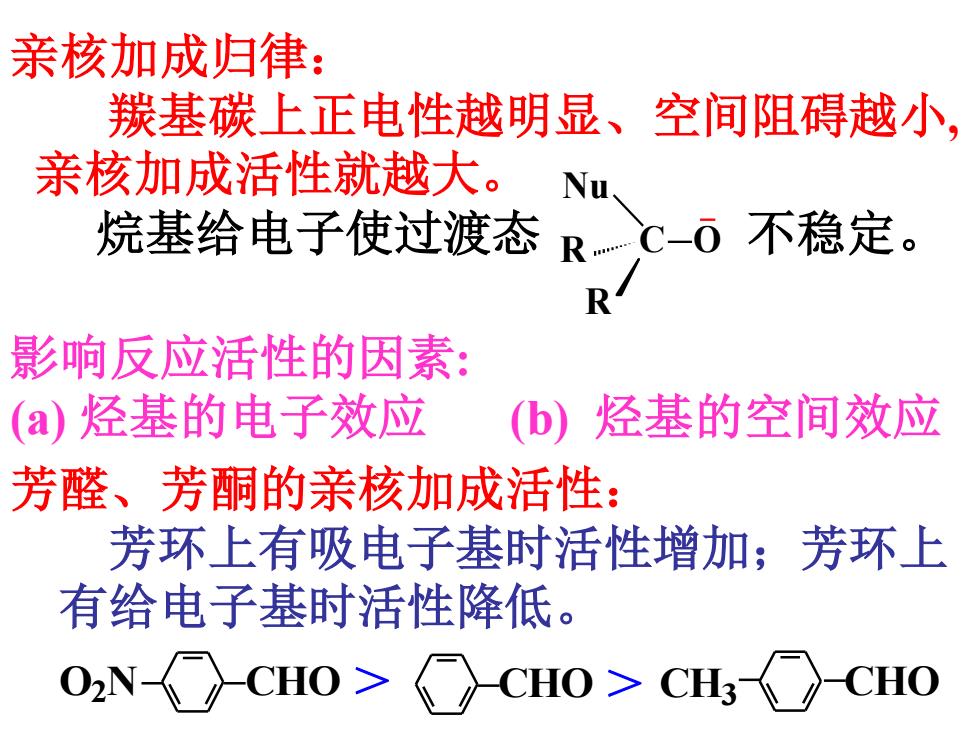
亲核加成归律: 羰基碳上正电性越明显、空间阻碍越小, 亲核加成活性就越大。 Nu 烷基给电子使过渡态RC-O不稳定。 影响反应活性的因素: (a)烃基的电子效应 (b) 烃基的空间效应 芳醛、芳酮的亲核加成活性: 芳环上有吸电子基时活性增加;芳环上 有给电子基时活性降低
亲核加成归律: 羰基碳上正电性越明显、空间阻碍越小, 亲核加成活性就越大。 烷基给电子使过渡态 不稳定。 Nu R C O R 芳醛、芳酮的亲核加成活性: 芳环上有吸电子基时活性增加;芳环上 有给电子基时活性降低。 O2 N CHO > CHO > CH3 CHO 影响反应活性的因素: (a) 烃基的电子效应 (b) 烃基的空间效应

11.6.2羰基的亲核加成 (1)与亚硫酸氢钠加成 ONa OH R-CZH -R-C-SO3H-R-C-SO3Na (C) HO ONa H(CH3) H(CH3) OH HCI/ANaCI+S02+H2O R-C-SO3Na-R-C-H+NaHSO3 H(CH3) (CH3) Na2CONa2SO3+C02+H20 反应特点: ·所有8个C以下的醛、脂肪族甲基酮和8个 C以下的环酮均能发生该反应。 a-羟基磺酸钠在饱和的NaHSO,溶液中为 结晶。用于鉴定、分离醛、酮
11.6.2 羰基的亲核加成 R C H (CH3 ) (CH3 ) (CH3 ) + S O HO ONa R C SO3 H ONa H R C SO3 Na OH H O . . (CH3 ) (CH3 ) R C SO3 Na OH H O R C H NaHSO3 HCl/ Na2 CO3 NaCl SO2 H2O CO2 H2O + + + + Na2 SO3 + (1) 与亚硫酸氢钠加成 • 所有8 个C以下的醛、脂肪族甲基酮和8 个 C以下的环酮均能发生该反应。 • α–羟基磺酸钠在饱和的NaHSO3溶液中为 结晶。用于鉴定、分离醛、酮。 反应特点:
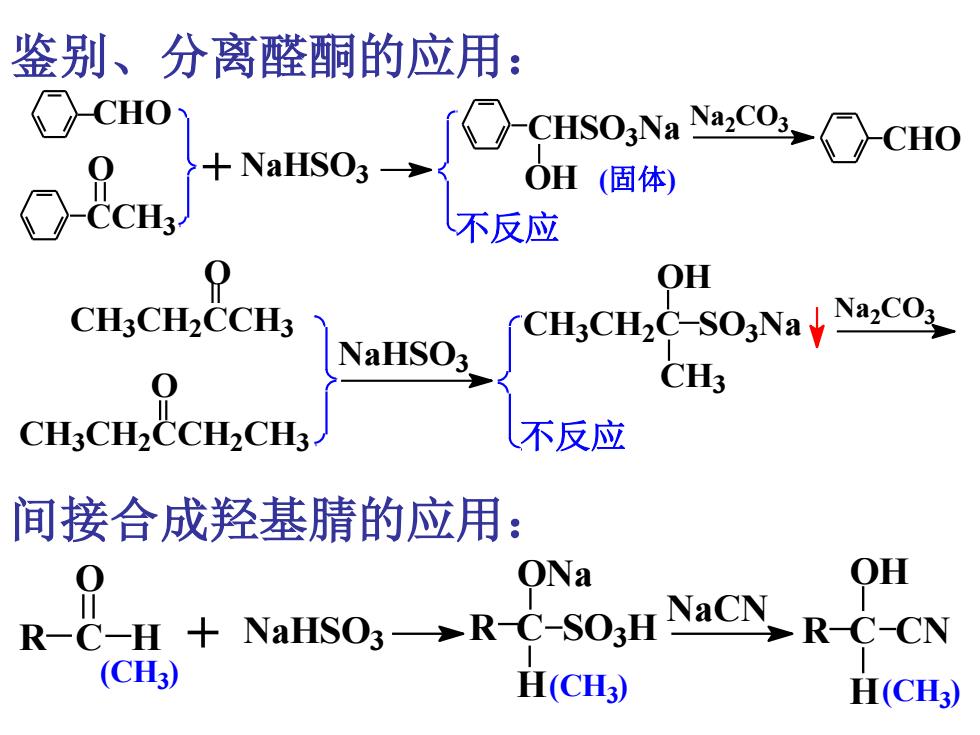
鉴别、分离醛酮的应用: CHO、 9 }+NaHSO3 OH(固体) 不反应 OH CH3CH2CCH3 NaHSO3 CHsCH2C-SONayNaCO CH3CH2CCH2CH3 不反应 间接合成羟基腈的应用: ONa OH R-C-H NaHSO3->R-C-SO3H NaCN-R-C-CN (C) H(CH3)
CH3 CH2 CCH3 CH3 CH2 CCH2 CH3 NaHSO3 不反应 Na2 CO3 O O CH3 CH2 C SO3 Na OH CH3 CHO CCH3 O + NaHSO3 CHSO3 Na OH Na2 CO3 CHO (固体) 不反应 鉴别、分离醛酮的应用: R C H (CH3 ) (CH3 ) (CH3 ) + R C SO3 H ONa H O NaHSO3 NaCN R C CN OH H 间接合成羟基腈的应用: