
(3)B的浓度(又称为B的物质的量浓度)CBndefCBV即B的物质的量与混合物体积V的比值mol m-3CB 单位是Cβ =[B]mol .dm-3但常用单位是
8 (又称为 B的物质的量浓度) B B def n c V 即B的物质的量与混合物体积V的比值 但常用单位是 3 mol dm− B c =[B] (3) B的浓度 B c 单位是 3 mol m− B c

(4)B的摩尔分数XBndefBPZnA即指B的物质的量与混合物总的物质的量之比称为溶质B的摩尔分数,又称为物质的量分数摩尔分数的单位为1JB 表示气态混合物中摩尔分数常用
9 B B A A def n x n 即指B的物质的量与混合物总的物质的量之比称 为溶质B的摩尔分数,又称为物质的量分数。 摩尔分数的单位为1 (4) B的摩尔分数 B x 气态混合物中摩尔分数常用 yB 表示

在溶液中,表示溶质浓度的方法有:(1)溶质B的质量摩尔浓度mBdefRmg = bBmBm(A)溶质B的物质的量与溶剂A的质量之比称为溶质B的质量摩尔浓度质量摩尔浓度的单位是 mol ·kg这个表示方法的优点是可以用准确的称重法来配制溶液,不受温度影响,电化学中用的很多10
10 (1)溶质B的质量摩尔浓度mB B B def (A) n m m 溶质B的物质的量与溶剂A的质量之比称为溶 质B的质量摩尔浓度。 这个表示方法的优点是可以用准确的称重法来 配制溶液,不受温度影响,电化学中用的很多 在溶液中,表示溶质浓度的方法有: 质量摩尔浓度的单位是 1 mol kg− m b B B =

s3.1偏摩尔量PartialmolarquantitiesaGeG,=(on一、定义T,p,nc+B偏摩尔量的物理意义二、三、集合公式G= Gana+ GpnB12
12 §3.1 偏摩尔量 Partial molar quantities 一、定义 二、偏摩尔量的物理意义 三、集合公式 , , C B def B B T p n G G n = G = GAnA+ GBnB
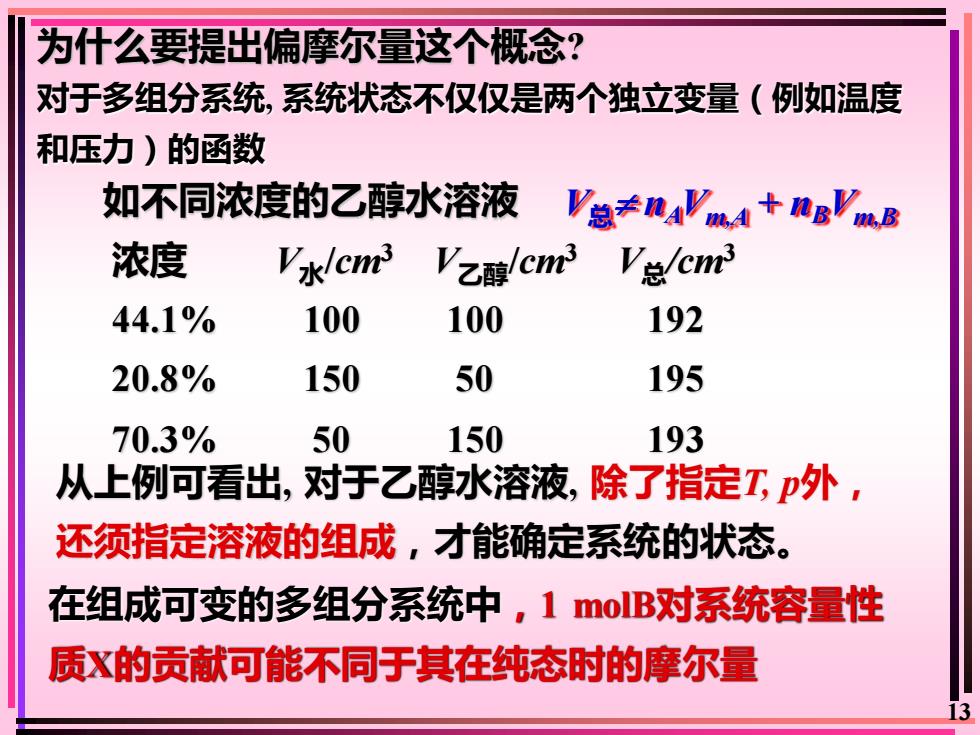
为什么要提出偏摩尔量这个概念?对于多组分系统,系统状态不仅仅是两个独立变量(例如温度和压力)的函数如不同浓度的乙醇水溶液V总+naVmA + ngVmB浓度V总/cm3Vk/cm3/cm3Vz醇10010019244.1%1505019520.8%5015019370.3%从上例可看出,对于乙醇水溶液,除了指定TP外,还须指定溶液的组成,才能确定系统的状态,在组成可变的多组分系统中,1molB对系统容量性质的贡献可能不同于其在纯态时的摩尔量13
13 为什么要提出偏摩尔量这个概念? 对于多组分系统, 系统状态不仅仅是两个独立变量(例如温度 和压力)的函数 如不同浓度的乙醇水溶液 浓度 V水/cm3 V乙醇/cm3 V总/cm3 44.1% 100 100 192 20.8% 150 50 195 70.3% 50 150 193 从上例可看出, 对于乙醇水溶液, 除了指定T, p外, 还须指定溶液的组成,才能确定系统的状态。 V总 nAVm,A + nBVm,B 在组成可变的多组分系统中,1 molB对系统容量性 质X的贡献可能不同于其在纯态时的摩尔量