
★热力学第一定律 热力学第一定律的实质是能量守恒与转化定律 能量守恒定律认为:能量具有各种不同的形式,它能从一种 形式转化为另一种形式,从一个物体传递给另一个物体,但 在转化和传递的过程中能量的总值不变。 吸热 得功W →U2 在任何过程中 对于封闭体系热 ,系统热力 学 力学第一定律为: U2=U+0+W 能的增加等于 △U=O+W 系统从环境吸 U,-U=0+W 收的热与环境 对于微小变化: 对系统所做的 dU=δO+δW 功之和
★ 热力学第一定律 U2 U1 Q W U2 U1 Q W U1 U2 得 吸功 热W Q 热力学第一定律的实质是能量守恒与转化定律 U Q W 对于封闭体系热 力学第一定律为: 能量守恒定律认为:能量具有各种不同的形式,它能从一种 形式转化为另一种形式,从一个物体传递给另一个物体,但 在转化和传递的过程中能量的总值不变。 在任何过程中 ,系统热力学 能的增加等于 系统从环境吸 收的热与环境 对系统所做的 功 之 和 。 对于微小变化: dU δQ δW

B·焰 Enthalpy and enthalpy change 对于封闭系统,在恒容过程中, △V=0,W=0 Q=△U 2为恒容反应热(即弹式量热计所测之热) 在恒压过程中 △U=Qp-Pex△V U2-Uj=Qp-Pe(V2-V) U2-U1=Qp-(p2'2-p) Qp=(U2+p2'2)-(U1+p') 焓: H=U+pV 焓变: 9,=H2-H,=△H(即恒压量热计所测之热) 吸热反应△H>0,放热反应△H<0
● 对于封闭系统,在恒容过程中 V=0,W=0 QV U QV为恒容反应热(即弹式量热计所测之热) 2 2 2 1 1 1 2 1 2 2 1 1 2 1 2 1 Q (U p V ) U p V U U Q p V p V U U Q p V V U Q p V p p p ex p ex 吸热反应 H 0,放热反应 H 0 ● 在恒压过程中 焓变: Qp H2 H1 H 焓: H U pV (即恒压量热计所测之热)

焓和焓变一反应自发性的一种判据 焓(enthalpy,.符号为H)可方便地理解为该物质中热 的含量一物质内部可供转化为热的能量。焓值越低,稳 定性就越高;反之亦然。 焓变定义为化学或物理过程中吸收或放出的热量, 即,过程完成之后的终态物质的焓与过程发生之前的始 态物质的焓之差: △H=∑H(终态物)一ΣH(始态物)
焓和焓变—反应自发性的一种判据 焓(enthalpy, 符号为H) 可方便地理解为该物质中热 的含量— 物质内部可供转化为热的能量。焓值越低, 稳 定性就越高; 反之亦然。 焓变定义为化学或物理过程中吸收或放出的热量, 即, 过程完成之后的终态物质的焓与过程发生之前的始 态物质的焓之差: △H = ΣH(终态物)-ΣH(始态物)

热容(heat capacity,c) 使某物体温度升高1K时所需的热量。热容除以 物质的量得摩尔热容(Molar heat capacity)Cm 2=nCm△T i拉aw0l6 物质 比热容(J℃g) H20(0 4.18 100.0J的热量可使1mol H0(S) 2.03 Al(s) 0.89 铁的温度上升3.98K,求铁的 Fe(s) 0.45 Hg (I) 0.14 C(s) 0.71 Solution 100.0J Cm= 25.1Jmol-1.K-1 n△T (1mol)(3.98K)
Q = nCm T 热容(heat capacity, c) 使某物体温度升高1K时所需的热量。热容除以 物质的量得摩尔热容 (Molar heat capacity) Cm 100.0 J 的热量可使 1mol 铁的温度上升 3.98 K,求铁的 Cm。 1 1 m 25 1 J mol K 1mol 3 98K 100 0J . ( )( . ) . n T Q C 物质 比热容 (J/℃·g) H2O (l) 4.18 H2O (s) 2.03 Al (s) 0.89 Fe (s) 0.45 Hg (l) 0.14 C (s) 0.71 Solution
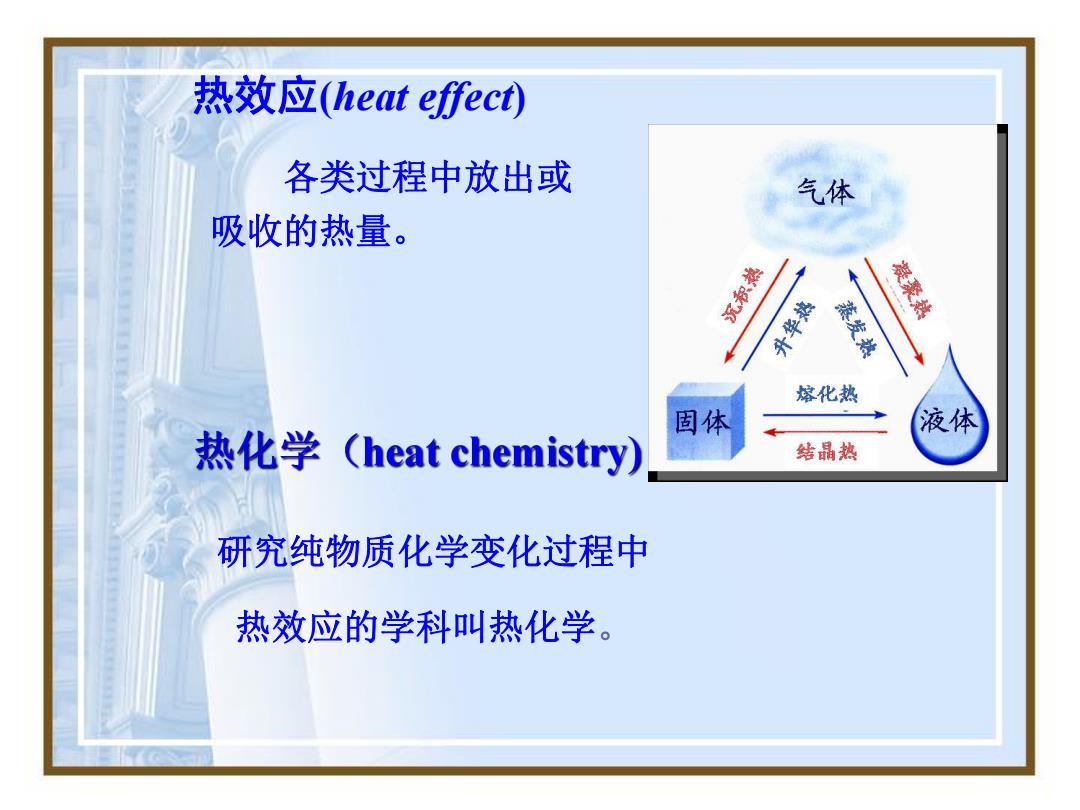
热效应heat effect) 各类过程中放出或 气体 吸收的热量。 沉积热 升华热 蒸发热 凝聚热 熔化热 固体 液体 热化学(heat chemistry) 结晶热 研究纯物质化学变化过程中 热效应的学科叫热化学
各类过程中放出或 吸收的热量。 热效应(heat ef ect) 研究纯物质化学变化过程中 热效应的学科叫热化学