
③如若一个还原反应能够发生 必须是艾林罕姆图上位于下面的金 +250 Ag2O Cuo 属与位于上面的金属氧化物之间相互 作用的结果。反之,位于上面的金属 C0+C02 ,0与位于下面的金属氧化物之间的反应 -250 FeO 将不发生。 +C0五 表明位于下面的金属还原性强。 -500 ZnO SiOz 根据这个原则,从艾林罕姆图可 750 C-CO g 以排列出常见还原剂如在1073K的相 Ca0 1000 对强弱次序! Ca>Mg>Al>Ti> 500 1000 1500 20002500 3000 Si>Mn>Na. T/K 同理,常见氧化剂在1073K的强弱 次序为: HgO>Ag2O>Fe2O3>Cu2O>NiO>Fe30>CoO
③ 如若一个还原反应能够发生 ,必须是艾林罕姆图上位于下面的金 属与位于上面的金属氧化物之间相互 作用的结果。反之,位于上面的金属 与位于下面的金属氧化物之间的反应 将不发生。 表明位于下面的金属还原性强。 根据这个原则, 从艾林罕姆图可 以排列出常见还原剂如在1073K的相 对强弱次序: Ca>Mg>A1>Ti> Si>Mn>Na. 同理, 常见氧化剂在1073K的强弱 次序为: HgO>Ag2O>Fe2O3>Cu2O>NiO>Fe3O4>CoO 图 8.2 金属氧化的自由能—温度图 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2

举C还原Al,O3为例来说 +250 Ag20 明这个问题。从左图可以发 Cu 现,在低于2300K温度时, low./ 0 C0+C02 2+H20 C-CO线位于AI-AlO,线之 250 Fe 上,表明A1,O3的生成自由能 C+C02 比C0要负,所以在低于2300 500 ZnO SiO, K时,C不能用作AlO3的还 750 CCO Oz MgO 原剂。但当温度超过2300K Al203 CaO 1000 时C0的生成自由能比AlO3 的要负,即C在大于2300K 500 1000 1500 2000 2500 3000 T/K 时能从A1O3中夺取氧而使 Al203还原
举C还原Al2O3为例来说 明这个问题。从左图可以发 现,在低于2300 K温度时, C-CO线位于Al-Al2O3线之 上,表明Al2O3的生成自由能 比CO要负,所以在低于2300 K时,C不能用作Al2O3的还 原剂。但当温度超过2300 K 时CO的生成自由能比Al2O3 的要负,即C在大于2300 K 时能从Al2O3中夺取氧而使 Al 图 8.2 金属氧化的自由能—温度图 2O3还原。 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2
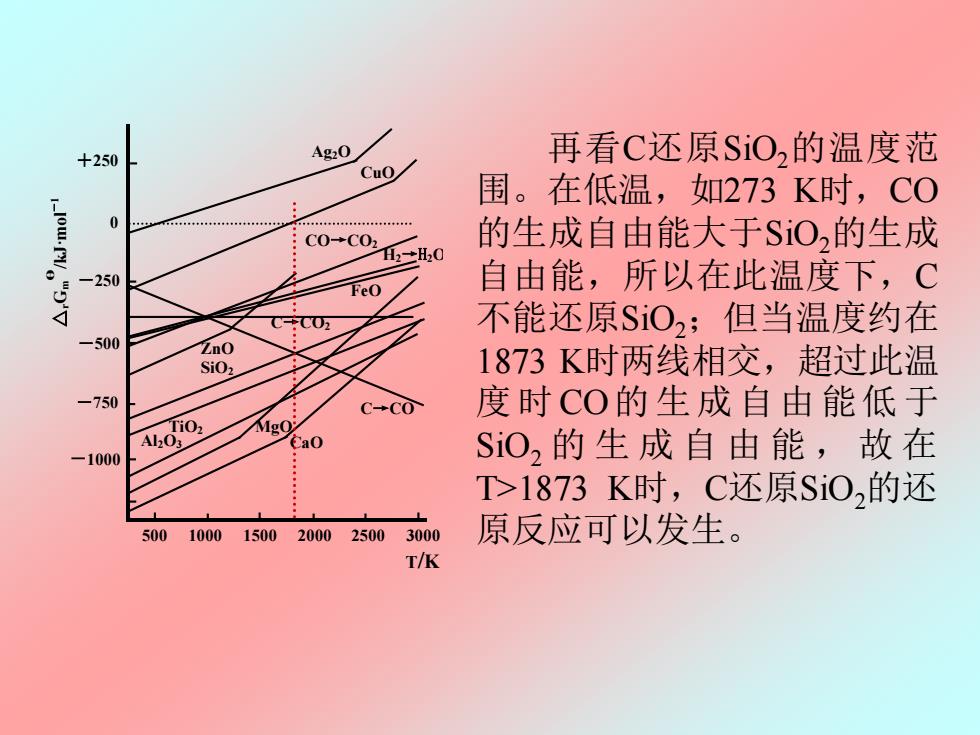
+250 Ag20 再看C还原SO,的温度范 Cuo 围。在低温,如273K时,C0 C0→C02 的生成自由能大于SiO,的生成 H2+H20 -250 自由能,所以在此温度下,C FeO 不能还原SiO2;但当温度约在 -500 ZnO SiOz 1873K时两线相交,超过此温 -750 C-CO 度时CO的生成自由能低于 Mgo Ca0 -1000 Si02的生成自由能,故在 T>1873K时,C还原SiO,的还 500 1000 1500 2000 25003000 原反应可以发生。 T/K
图 8.2 金属氧化的自由能—温度图 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2 再看C还原SiO2的温度范 围。在低温,如273 K时,CO 的生成自由能大于SiO2的生成 自由能,所以在此温度下,C 不能还原SiO2;但当温度约在 1873 K时两线相交,超过此温 度 时 CO的 生成 自由 能低 于 SiO2 的生成自由能 , 故 在 T>1873 K时,C还原SiO2的还 原反应可以发生
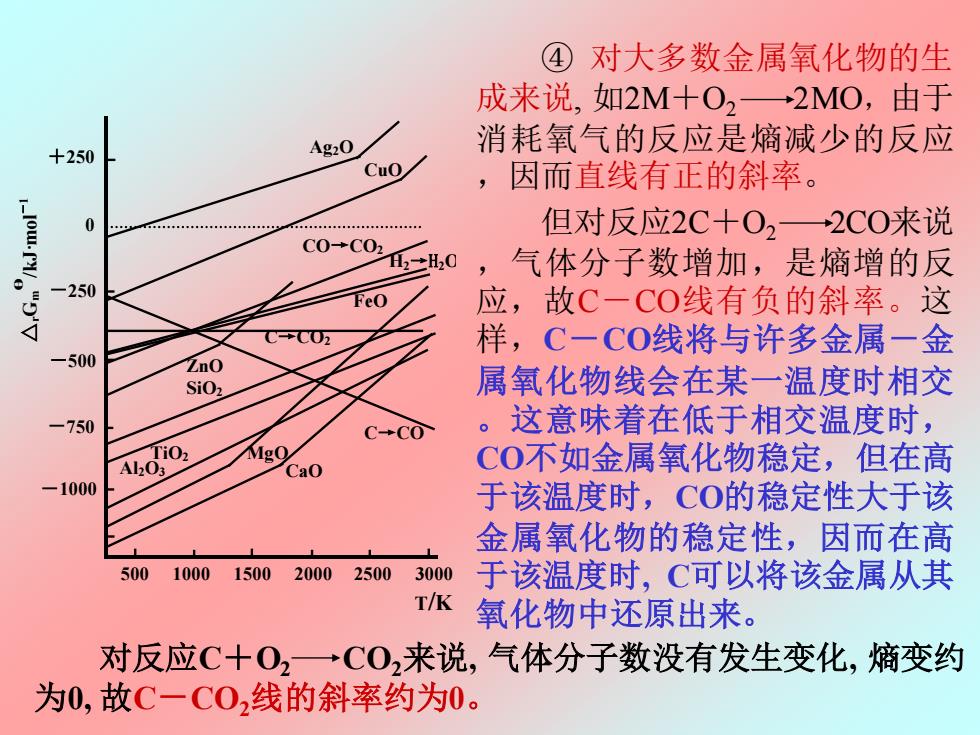
④对大多数金属氧化物的生 成来说,如2M十O2→2MO,由于 消耗氧气的反应是熵减少的反应 +250 Ag2O Cuo ,因而直线有正的斜率。 0 但对反应2C+0,一2C0来说 C0+C02 12H20 ,气体分子数增加,是熵增的反 250 Feo 应,故C一CO线有负的斜率。这 样,C一CO线将与许多金属一金 500 ZnO SiOz 属氧化物线会在某一温度时相交 750 CCO 。这意味着在低于相交温度时, Aofio Cao C0不如金属氧化物稳定,但在高 1000 于该温度时,CO的稳定性大于该 金属氧化物的稳定性,因而在高 500 10001500 20002500 3000 于该温度时,C可以将该金属从其 T/K 氧化物中还原出来。 对反应C十02一→C02来说,气体分子数没有发生变化,熵变约 为0,故C一C0,线的斜率约为0
但对反应2C+O2 2CO来说 ,气体分子数增加,是熵增的反 应,故C-CO线有负的斜率。这 样,C-CO线将与许多金属-金 属氧化物线会在某一温度时相交 。这意味着在低于相交温度时, CO不如金属氧化物稳定,但在高 于该温度时,CO的稳定性大于该 金属氧化物的稳定性,因而在高 于该温度时, C可以将该金属从其 氧化物中还原出来。 对反应C+O2 CO2来说, 气体分子数没有发生变化, 熵变约 为0, 故C-CO2线的斜率约为0。 ④ 对大多数金属氧化物的生 成来说, 如2M+O2 2MO,由于 消耗氧气的反应是熵减少的反应 ,因而直线有正的斜率。 图 8.2 金属氧化的自由能—温度图 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2
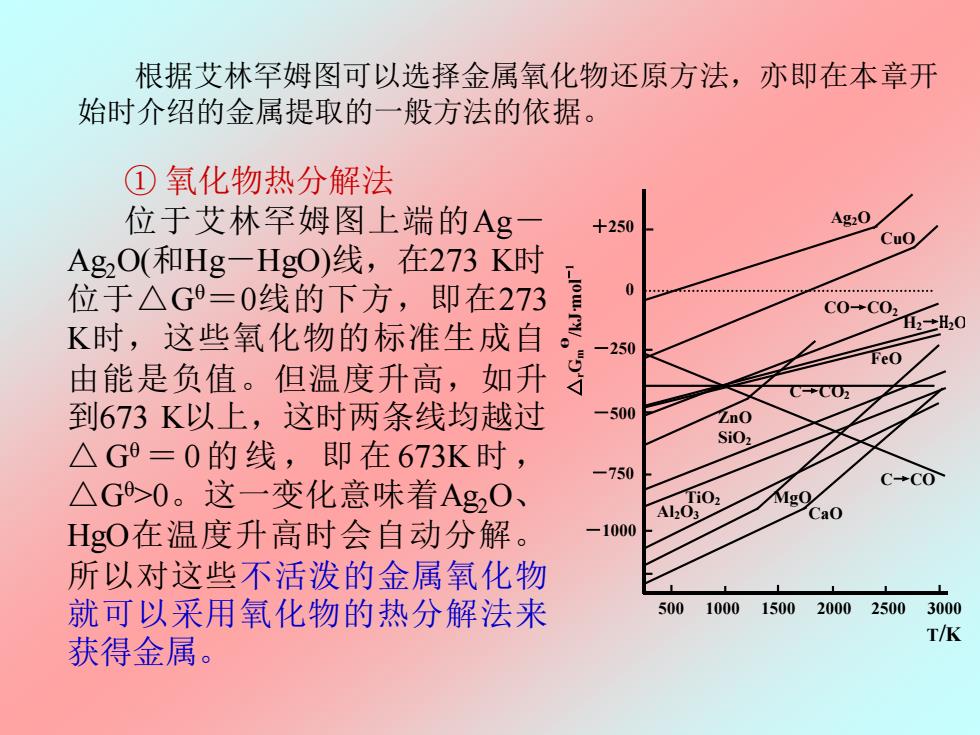
根据艾林罕姆图可以选择金属氧化物还原方法,亦即在本章开 始时介绍的金属提取的一般方法的依据。 ①氧化物热分解法 位于艾林罕姆图上端的Ag +250 Ag2O Cuo Ag2O(和Hg-HgO)线,在273K时 位于△G=0线的下方,即在273 C0+C02 K时,这些氧化物的标准生成自 H2+H20 -250 FeO 由能是负值。但温度升高,如升 C+C0五 到673K以上,这时两条线均越过 500 ZnO SiO2 △G9=0的线,即在673K时, -750 △G>0。这一变化意味着Ag20、 CCO AoO Ca0 HgO在温度升高时会自动分解。 -1000 所以对这些不活泼的金属氧化物 就可以采用氧化物的热分解法来 5001000 1500200025003000 T/K 获得金属
根据艾林罕姆图可以选择金属氧化物还原方法,亦即在本章开 始时介绍的金属提取的一般方法的依据。 ① 氧化物热分解法 位于艾林罕姆图上端的Ag- Ag2O(和Hg-HgO)线,在273 K时 位于△Gθ=0线的下方,即在273 K时,这些氧化物的标准生成自 由能是负值。但温度升高,如升 到673 K以上,这时两条线均越过 △ Gθ = 0的 线, 即在 673K时 , △Gθ>0。这一变化意味着Ag2O、 HgO在温度升高时会自动分解。 所以对这些不活泼的金属氧化物 就可以采用氧化物的热分解法来 获得金属。 图 8.2 金属氧化的自由能—温度图 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2