
73第一过渡系元素的化学 7.3.1单质及化合物的制备 单质的提取 1方法 (1)以天然状态存在的单质的物理分离法 如淘金 (2)热分解法 2Hg0→2Hg+02 2Ag,0△4Ag+0, (3)热还原法 △ a以C作还原剂 ZnO+CZn+CO 1473K b用氢作还原剂WO3+3H2 W+3H20 c用比较活泼的金属作还原剂 Cr203+2A1+ 2Cr+A1203 TiC1+2Mg → Ti+2MgC12 电解 (4)电解法 NaCl Na+1/2C12
7.3 第一过渡系元素的化学 7.3.1 单质及化合物的制备 一 单质的提取 1 方法 (1) 以天然状态存在的单质的物理分离法 如淘金 (2) 热分解法 △ △ 2HgO 2Hg+O2 2Ag2O 4Ag+O2 (3) 热还原法 △ a 以C作还原剂 ZnO + C Zn+CO 1473K b 用氢作还原剂 WO3+3H2 W+3H2O c 用比较活泼的金属作还原剂 Cr2O3+2A1 2Cr+A12O3 TiC14+2Mg Ti+2MgC12 (4) 电解法 NaC1 Na+1/2C12 电解

2还原过程的热力学 应用自由能变△G可以判断某一金属从其化合物中还原出 来的难易以及如何选择还原剂等问题。 金属氧化物越稳定,则还原成金属就越困难。各种不同金 属氧化物还原的难易可定量地比较它们的生成自由能来确定。 氧化物的生成自由能越负,则氧化物越稳定,金属亦就越 难被还原。 Ellingham(艾林罕姆)在1944年首先将氧化物的标准生成自 由能对温度作图(以后又对硫化物、氯化物、氟化物等作类似的 图形),用以帮助人们: ①判断哪种氧化物更稳定 ②比较还原剂的强弱 ③估计还原反应进行的温度条件 ④选择还原方法 这种图现在称为自由能一温度图,或艾林罕姆图。这种图 在冶金学上具有特别重要的意义
应用自由能变△Gθ可以判断某一金属从其化合物中还原出 来的难易以及如何选择还原剂等问题。 金属氧化物越稳定,则还原成金属就越困难。各种不同金 属氧化物还原的难易可定量地比较它们的生成自由能来确定。 氧化物的生成自由能越负,则氧化物越稳定,金属亦就越 难被还原。 Ellingham(艾林罕姆)在1944年首先将氧化物的标准生成自 由能对温度作图(以后又对硫化物、氯化物、氟化物等作类似的 图形),用以帮助人们: ① 判断哪种氧化物更稳定 ② 比较还原剂的强弱 ③ 估计还原反应进行的温度条件 ④ 选择还原方法 2 还原过程的热力学 这种图现在称为自由能—温度图,或艾林罕姆图。这种图 在冶金学上具有特别重要的意义
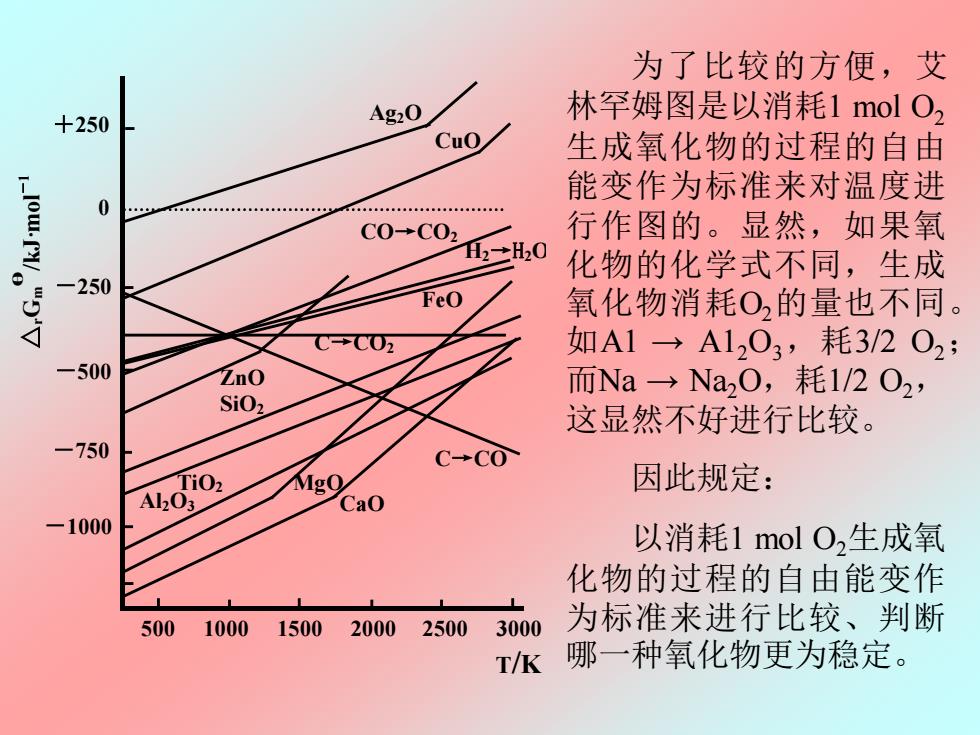
为了比较的方便,艾 Ag2O 林罕姆图是以消耗1molO, +250 Cuo 生成氧化物的过程的自由 能变作为标准来对温度进 0 8用8用8用用票8来看用8 不”年”无”。 C0→C02 行作图的。显然,如果氧 12→H20 化物的化学式不同,生成 -250 FeO 氧化物消耗O2的量也不同。 如A1→A1203,耗3/2O2; 500 ZnO 而Na→Na0,耗1/2O2, SiO2 这显然不好进行比较。 750 C→CO ALoO, Mg0 因此规定: 1000 以消耗1molO,生成氧 化物的过程的自由能变作 500 1000 1500 20002500 3000 为标准来进行比较、判断 T/K 哪一种氧化物更为稳定
为了比较的方便,艾 林罕姆图是以消耗1 mol O2 生成氧化物的过程的自由 能变作为标准来对温度进 行作图的。显然,如果氧 化物的化学式不同,生成 氧化物消耗O2的量也不同。 如A1 → A12O3,耗3/2 O2; 而Na → Na2O,耗1/2 O2, 这显然不好进行比较。 因此规定: 以消耗1 mol O2生成氧 化物的过程的自由能变作 为标准来进行比较、判断 哪一种氧化物更为稳定。 图 8.2 金属氧化的自由能—温度图 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2
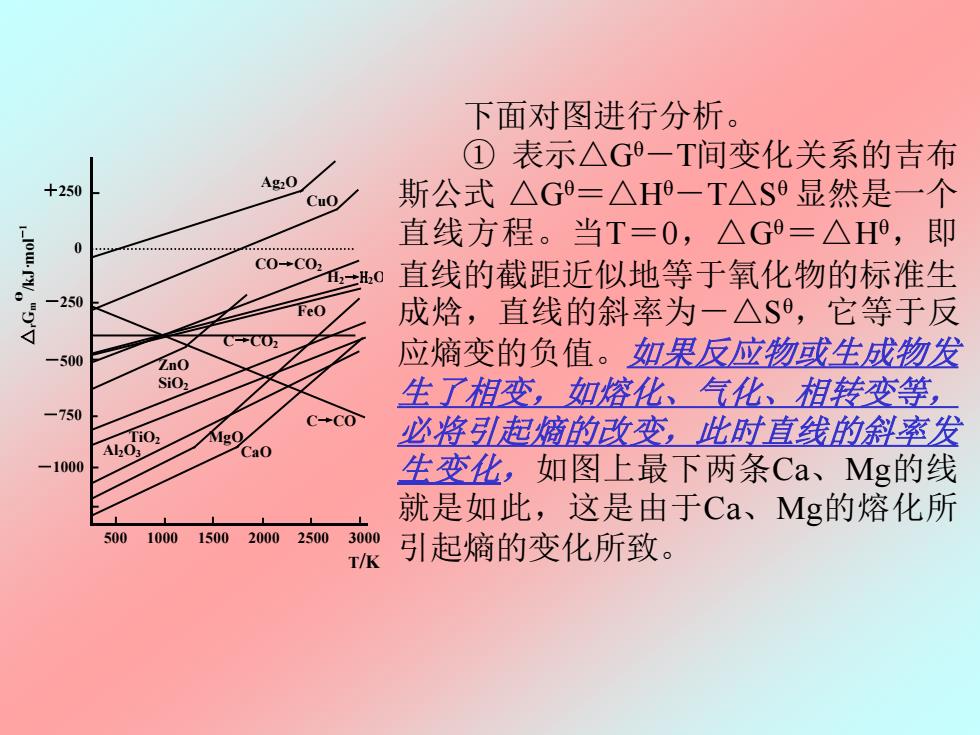
下面对图进行分析。 ①表示△G一T间变化关系的吉布 +250 Ag2O CuO 斯公式△G=△H-T△S显然是一个 直线方程。当T=0,△G=△H,即 C0+C02 2→H0 直线的截距近似地等于氧化物的标准生 250 成焓,直线的斜率为一△S,它等于反 C0五 -500 应熵变的负值。如果反应物或生成物发 SiO, 生了相变,如熔化、气化、相转变等, -750 C-CO 4,00 必将引起熵的改变,此时直线的斜率发 CaO 1000 生变化,如图上最下两条Ca、Mg的线 就是如此,这是由于Ca、Mg的熔化所 500 10001500200025003000 T/K 引起熵的变化所致
下面对图进行分析。 ① 表示△Gθ-T间变化关系的吉布 斯公式 △Gθ=△Hθ-T△S θ 显然是一个 直线方程。当T=0,△Gθ=△Hθ ,即 直线的截距近似地等于氧化物的标准生 成焓,直线的斜率为-△S θ ,它等于反 应熵变的负值。如果反应物或生成物发 生了相变,如熔化、气化、相转变等, 必将引起熵的改变,此时直线的斜率发 生变化,如图上最下两条Ca、Mg的线 就是如此,这是由于Ca、Mg的熔化所 引起熵的变化所致。 图 8.2 金属氧化的自由能—温度图 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2
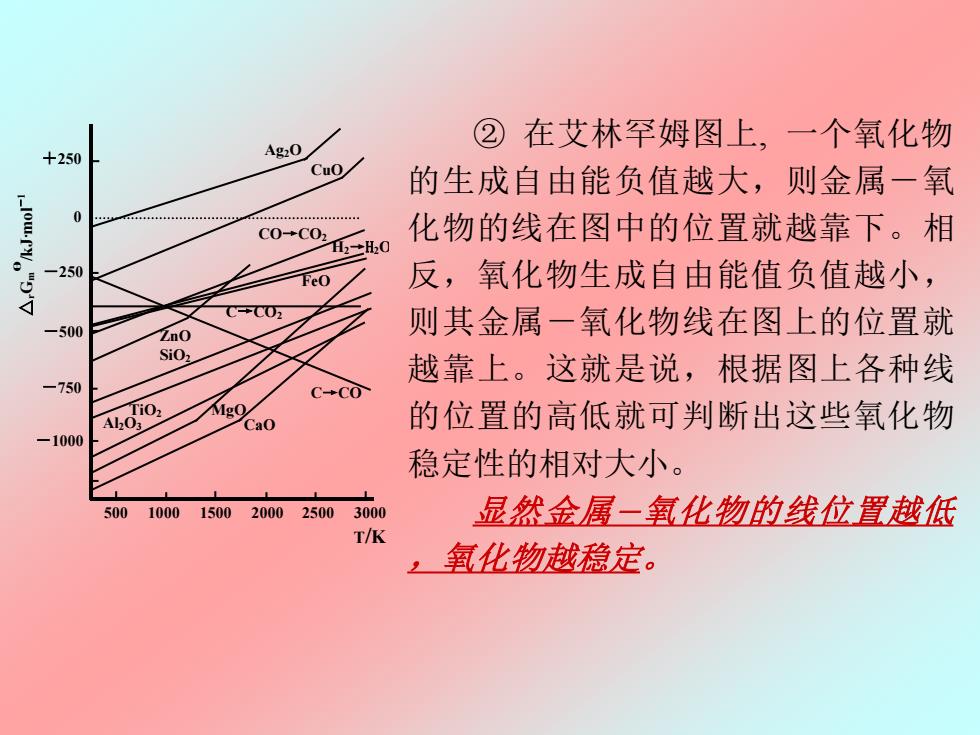
②在艾林罕姆图上,一个氧化物 +250 Ag2O Cuo 的生成自由能负值越大,则金属一氧 10:V C0+C02 化物的线在图中的位置就越靠下。相 H2+H20 -250 FeO 反,氧化物生成自由能值负值越小, C→C0万 -500 ZnO 则侧其金属一氧化物线在图上的位置就 SiOz 越靠上。这就是说,根据图上各种线 -750 C-CO AkoiO, Cao 的位置的高低就可判断出这些氧化物 100( 稳定性的相对大小。 500 1000 15002000 25003000 显然金属一氧化物的线位置越低 T/K ,氧化物越稳定
② 在艾林罕姆图上, 一个氧化物 的生成自由能负值越大,则金属-氧 化物的线在图中的位置就越靠下。相 反,氧化物生成自由能值负值越小, 则其金属-氧化物线在图上的位置就 越靠上。这就是说,根据图上各种线 的位置的高低就可判断出这些氧化物 稳定性的相对大小。 显然金属-氧化物的线位置越低 图 8.2 金属氧化的自由能—温度图 ,氧化物越稳定。 Ag2O CuO ZnO FeO SiO2 MgO Al2O3 CaO C→CO2 C→CO CO→CO2 △ Gr m θ /kJ·mol -1 +250 0 -250 -500 -750 -1000 500 1000 1500 2000 2500 3000 T/K H2→H2O TiO2