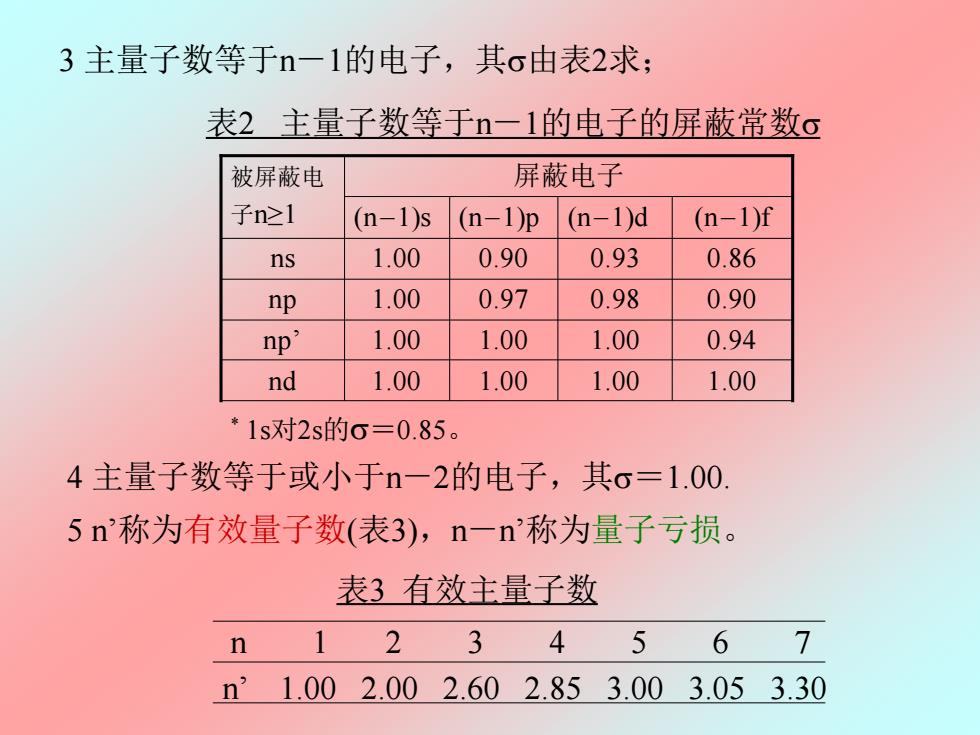
3主量子数等于n一1的电子,其o由表2求; 表2主量子数等于n一1的电子的屏蔽常数s 被屏蔽电 屏蔽电子 子n≥1 (n-1)s (n-1)p (n-1)d (n-1)f ns 1.00 0.90 0.93 0.86 np 1.00 0.97 0.98 0.90 np' 1.00 1.00 1.00 0.94 nd 1.00 1.00 1.00 1.00 *1s对2s的o=0.85。 4主量子数等于或小于n-一2的电子,其o=1.00. 5n称为有效量子数(表3),n一n称为量子亏损。 表3有效主量子数 n 2 3 4 5 67 n1.002.002.602.853.003.053.30
4 主量子数等于或小于n-2的电子,其=1.00. 5 n’称为有效量子数(表3),n-n’称为量子亏损。 表3 有效主量子数 n 1 2 3 4 5 6 7 n’ 1.00 2.00 2.60 2.85 3.00 3.05 3.30 3 主量子数等于n-1的电子,其由表2求; 表2 主量子数等于n-1的电子的屏蔽常数 * 1s对2s的=0.85。 np’ 1.00 1.00 1.00 0.94 nd 1.00 1.00 1.00 1.00 np 1.00 0.97 0.98 0.90 ns 1.00 0.90 0.93 0.86 (n-1)s (n-1)p (n-1)d (n-1)f 被屏蔽电 屏蔽电子 子n≥1

如,对基态K原子,如为1s22s22p3s23p64s1,则对于4s1电子, 6=6×0.93p+23s)×1+(62p)+229)+21s×1=17.4 Z*=Z-o=19-17.4=1.6 由表3,n=4,n=2.85,故 EK,4s1=-1312.13(Z*n)2 =-1312.13(1.6/2.85)2 =-413.5 kJmol-1 如为1s22s22p3s23p3dl,则对于3d1电子, 0=(63p)+23s+62p)+22s)+21s×1=18 Z*=Z-σ=19-18=1 由表3,n=3,n=2.60,故 EK,3d=-1312.13(Z*n')2 =-1312.13(1/2.60)2 =-194.1 kJ.mol-1 显然,对于K,E≥E4s,3山轨道的能量大于s轨道的能量
如,对基态K原子,如为1s 22s 22p 63s 23p 64s 1 ,则对于4s 1电子, =6×0.9 (3p)+2 (3s)×1+(6 (2p)+2 (2s)+2 (1s))×1=17.4 Z * =Z- =19-17.4=1.6 由表3,n=4,n’=2.85,故 EK,4s 1=-1312.13(Z* /n’)2 =-1312.13(1.6/2.85) 2 =-413.5 kJ·mol-1 如为1s 22s 22p 63s 23p 63d 1 ,则对于3d 1电子, =(6 (3p)+2 (3s)+6 (2p)+2 (2s)+2 (1s))×1=18 Z * =Z- =19-18=1 由表3,n=3,n’=2.60,故 EK,3d 1=-1312.13(Z* /n’)2 =-1312.13(1/2.60) 2 =-194.1 kJ·mol-1 显然,对于K,E3d>E4s,3d轨道的能量大于4s轨道的能量

而对于Sc,用类似的方法求: 若为1s22s22p3s23p63d14s2,则对于4s电子, o=1×0.304s)+1×0.933d)+6×0.903p)+ (62p)+22s)+2(1s×1.00 =19.63 Z*=Z-0=21-19.63=2.37 由表3,n=4,n=2.85,故 Esc,4s=-1312.13(Z*/n')2 =-1312.13(2.37/2.85)2 =-907.4 kJmol-1 而对于3d电子, 0=1×(63p+23s)+62p)+22s)+21s)=18 Z*=Z-6=21-18=3 由表3,n=3,n=2.60,故 Ek,3d1=-1312.13(Z*/n')2 =-1312.13(3/2.60)2 =-1746.9 kJmol-1 显然,此时,E3<E4s,3d轨道的能量低于4s轨道的能量
而对于Sc,用类似的方法求: 若为1s 22s 22p 63s 23p 63d 14s 2 ,则对于4s电子, =1×0.30(4s)+1×0.93(3d)+6×0.90(3p)+ (6 (2p)+2 (2s)+2 (1s))×1.00 =19.63 Z * =Z- =21-19.63=2.37 由表3,n=4,n’=2.85,故 ESc,4s =-1312.13(Z* /n’)2 =-1312.13(2.37/2.85) 2 =-907.4 kJ·mol-1 而对于3d 1电子, =1×(6 (3p)+2 (3s)+6 (2p)+2 (2s)+2 (1s))=18 Z * =Z- =21-18=3 由表3,n=3,n’=2.60,故 EK,3d 1=-1312.13(Z* /n’)2 =-1312.13(3/2.60) 2 =-1746.9 kJ·mol-1 显然,此时,E3d<E4s,3d轨道的能量低于4s轨道的能量

计算说明: ★当3d轨道无电子时,4s轨道的能量小于3d轨道, ★当3d轨道有了电子之后,其能量下降,能量低 于4s轨道。此时,3d电子就成了内层电子。 这是由于随着Z增加,核电荷增加,对3d电子来说其有 效核电荷增加;另一方面,3d电子却增加了对4s电子的屏蔽 作用(3d电子对4s电子的σ=0.93,4s电子对4s电子的o=0.30), 结果使4s电子的钻穿效应减弱,从而使得E3d<E4s 除此之外, ★对于第五周期,5s与4d的能量十分接近,: ★对于第六周期,由于4f电子的屏蔽作用使得6s 和5d的能量差值又增加
★ 对于第五周期,5s与4d的能量十分接近; 计算说明: ★ 当3d轨道无电子时,4s轨道的能量小于3d轨道; ★ 当3d轨道有了电子之后,其能量下降; 能量低 于4s轨道。此时,3d电子就成了内层电子。 这是由于随着Z增加,核电荷增加,对3d电子来说其有 效核电荷增加;另一方面,3d电子却增加了对4s电子的屏蔽 作用 (3d电子对4s电子的=0.93,4s电子对4s电子的=0.30), 结果使4s电子的钻穿效应减弱,从而使得E3d<E4s。 除此之外, ★ 对于第六周期,由于4f电子的屏蔽作用使得 6s 和5d的能量差值又增加

7.2.3过渡元素的电子构型 过渡元素的价电子层结构中,有几种元素电子排布呈现“特殊?性, 如Cr、Mo的(n一1)d提前达半满状态成为(n一1)d5ns结构,而 同族的W却保持5d46s结构; Cu、Ag、Au的(n-I)d提前到达全满状态成为(n-1)dions'; Nb4d45s、Ru4d75s、Rh4d85s、Pd4d105s、Pt5d96s等。 即这些元素大多提前达半满或全满菡或接近半懣或全满的结构。 有人认为,这是由洪特规则所决定的。回答是否定的,洪特 规则即多轨道规则,是指量子数相同或是说组态一样时的电子排 布规则,即必须n、1相同,电子数相同。而Cr的3d44s2和3d54s是 量子数不同,或是说不同组态的排布。不能用洪特规则解释。 参看刘范“关于应用Hond规则的讨论”,化学通报,1983,141,37 这种特殊性可以用交换能解释
有人认为,这是由洪特规则所决定的。回答是否定的,洪特 规则即多轨道规则,是指量子数相同或是说组态一样时的电子排 布规则,即必须n、l相同,电子数相同。而Cr的3d 44s 2和3d 54s 1是 量子数不同,或是说不同组态的排布。不能用洪特规则解释。 参看刘范“关于应用Hond规则的讨论” ,化学通报,1983,141,37 7.2.3 过渡元素的电子构型 过渡元素的价电子层结构中,有几种元素电子排布呈现“特殊”性, 如 Cr、Mo的(n-1)d 提前达半满状态成为(n-1)d5ns1结构,而 同族的W却保持5d46s2结构; Cu、Ag、Au的(n-1)d 提前到达全满状态成为(n-1)d10ns1; Nb 4d45s1 、Ru 4d75s1 、Rh 4d85s1 、Pd 4d105s0 、Pt 5d96s1等。 即这些元素大多提前到达半满或全满或接近半满或全满的结构。 这种特殊性可以用交换能解释