
对“过渡元素”产生这几种不同的认识,其原因是BCu副 族、BZ副族有不同于其他副族元素的“独特”性质。 其实这种情况B族元素也有。 目前的这三种定义各有道理,第一种完全与周期表区元素 一致,第二种抓住了元素的化学性质的共同特征的本质,第三 种说明由金属到非金属的过渡的变化规律。因此,对于过渡元 素的定义,最好不要局限王仕么形式,而是看你过论问题的密 要而定。若是从宏观上讨论元素的性质变化规律,此时为了进 行对比,列出的性质中当然应该包括B、B元素的性质
其实这种情况ⅢB族元素也有。 对“过渡元素”产生这几种不同的认识,其原因是IB Cu副 族、IIB Zn副族有不同于其他副族元素的“独特”性质。 目前的这三种定义各有道理,第一种完全与周期表d区元素 一致,第二种抓住了元素的化学性质的共同特征的本质,第三 种说明由金属到非金属的过渡的变化规律。因此,对于过渡元 素的定义,最好不要局限于什么形式,而是看你讨论问题的需 要而定。若是从宏观上讨论元素的性质变化规律,此时为了进 行对比,列出的性质中当然应该包括IB、IIB元素的性质

2分类 为了讨论的方便,可以根据过渡元素的综合化学性质进行分类: ●前过渡元素,IVB一VIIB,不包括Mn,位于d区的前部, 其特征是其高价离子在水溶液中常发生聚合作用。 ●Mn到Cu,后过渡元素,第一过渡系的后部,其特点是以 水溶液化学和配位化学为其特征。 ●Ru、Rh、Pd,Os、Ir、Pt,再加上Ag、Au,称为贵金属 元素,特征也是丰富的配位化学。 ●第一过渡系称为轻过渡元素; ●第二、三过渡系,称为重过渡元素。 ★第一、第二和第三过渡系总称为“主过渡元素 ★区元素称为“内过遮元麦
★第一、第二和第三过渡系总称为“主过渡元素 ”; ★f区元素称为“内过渡元素” 。 2 分类 为了讨论的方便,可以根据过渡元素的综合化学性质进行分类: ●前过渡元素,IVB-VIIB,不包括Mn,位于d区的前部, 其特征是其高价离子在水溶液中常发生聚合作用。 ●Mn到Cu,后过渡元素,第一过渡系的后部,其特点是以 水溶液化学和配位化学为其特征。 ●Ru、Rh、Pd,Os、Ir、Pt,再加上Ag、Au,称为贵金属 元素,特征也是丰富的配位化学。 ●第一过渡系称为轻过渡元素; ●第二、三过渡系,称为重过渡元素

7.2d轨道的特征和过渡元素的 价电子层结构 d区过渡元素有许多不同于s区、p区和f区元素的特性: 如★离子多有颜色; ★多变价, ★易形成配合物; ★大多数化合物都有顺磁性等。 这些特性主要归功于d轨道参与成键 因此,在某种程度上来说: 过渡元素的化学就是轨道的化学
7.2 d轨道的特征和过渡元素的 价电子层结构 这些特性主要归功于d轨道参与成键 d区过渡元素有许多不同于s区、p区和f区元素的特性: 如 ★离子多有颜色; ★多变价; ★易形成配合物; ★大多数化合物都有顺磁性等。 过渡元素的化学就是d轨道的化学。 因此,在某种程度上来说:

7.2.1d轨道的特征 1d轨道比s、p轨道的数目多,成键可能性大; 2(n一1)d轨道的能量与ns、np接近,是易参与成键的内层轨道。 据实验测定发现,(n-l)d与ns或np轨道的能量差远较主族元素 的ns与np轨道的能量差小得多。 3d轨道在空间的取向和角度分布 五条d轨道的角度函数按其极大值在空间的分布可分为两组, 一 组在轴上,包括d2、d2y2,另一组在轴间夹角45°线上,包括 dy、dxz dyzo d轨道都有对称中心,是偶函数,具有g对称性。 4d电子的几率径向分布函数 电子的几率径向分布曲线,其峰的个数为(n-),显然d轨道比 同层的s、p轨道的峰的数目要少,因而钻到原子核附近的几率小, 相应的能量较高,因而造成了能级交错现象,使En-1)d>Es
电子的几率径向分布曲线,其峰的个数为(n-l),显然d轨道比 同层的s、p轨道的峰的数目要少,因而钻到原子核附近的几率小, 相应的能量较高,因而造成了能级交错现象,使E(n-1)d>Ens。 7.2.1 d轨道的特征 1 d轨道比s、p轨道的数目多,成键可能性大; 据实验测定发现,(n-1)d与ns或np轨道的能量差远较主族元素 的ns与np轨道的能量差小得多。 五条d 轨道的角度函数按其极大值在空间的分布可分为两组, 一组在轴上,包括dz 2、dx 2-y 2,另一组在轴间夹角45°线上,包括 dxy、dxz、dyz。 d 轨道都有对称中心,是偶函数,具有g对称性。 4 d电子的几率径向分布函数 3 d轨道在空间的取向和角度分布 2 (n-1)d轨道的能量与ns、np接近,是易参与成键的内层轨道
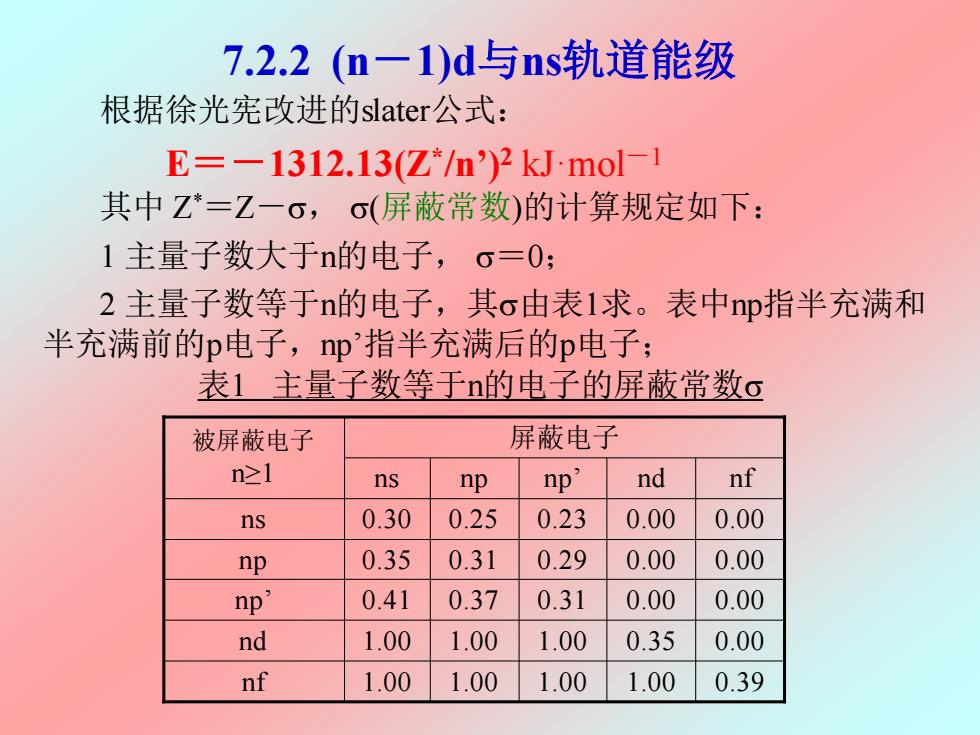
7.2.2(n-1)d与ns轨道能级 根据徐光宪改进的slater公式: E=一1312.13(Z*/n)2 kJ.mol-1 其中Z*=Z一6,σ(屏蔽常数)的计算规定如下: 1主量子数大于n的电子,o=0; 2主量子数等于n的电子,其c由表1求。表中np指半充满和 半充满前的p电子,np指半充满后的p电子; 表1主量子数等于n的电子的屏蔽常数o 被屏蔽电子 屏蔽电子 n≥1 ns np np' nd nf ns 0.30 0.25 0.23 0.00 0.00 np 0.35 0.31 0.29 0.00 0.00 np' 0.41 0.37 0.31 0.00 0.00 nd 1.00 1.00 1.00 0.35 0.00 nf 1.00 1.00 1.00 1.00 0.39
7.2.2 (n-1)d与ns轨道能级 根据徐光宪改进的slater公式: E=-1312.13(Z* /n’)2 kJ·mol-1 其中 Z * =Z-, (屏蔽常数)的计算规定如下: 1 主量子数大于n的电子, =0; 2 主量子数等于n的电子,其由表1求。表中np指半充满和 半充满前的p电子,np’指半充满后的p电子; 表1 主量子数等于n的电子的屏蔽常数 0.39 0.00 0.00 0.00 0.00 nf np’ 0.41 0.37 0.31 0.00 nf 1.00 1.00 1.00 1.00 nd 1.00 1.00 1.00 0.35 np 0.35 0.31 0.29 0.00 ns 0.30 0.25 0.23 0.00 ns np np’ nd 被屏蔽电子 屏蔽电子 n≥1