
2.滴定开始至sp前(Va>Vb,) 溶液组成HAc十NaAc 由于NaOH的加入,溶液中存在HAc-NaAc缓冲体系,溶液 的H值用缓冲溶液pH值的计算公式计算: ka离 C-Cp pH pKa+lg Vp V。-V。 Ac小张 Vb=19.98ml V.+Vp 19.98 [HAc]=C.V-C.V pH=4.75+g 20.00-19.98 Va+Vp =7.75
2. 滴定开始至sp前(Va> Vb,) a b a a b b a b - b b - V V C V C V HAc V V C V Ac HAc Ac pH pKa lg + − = + = = + 由于NaOH的加入,溶液中存在HAc-NaAc缓冲体系,溶液 的pH值用缓冲溶液pH值的计算公式计算: Ca=Cb a b b V V V pH pKa lg − = + Vb=19.98 ml 7.75 20.00 19.98 .75 = − = + 19.98 pH 4 lg 溶液组成 HAc+ NaAc

3.化学计量点时(V,=Vb=20.00ml) 溶液组成:NaAc 溶液的H值由Ac-的水解决定,用一元弱碱的公式计算。 ●<p=Kw/K3=10141.76×105=5.68×1010 ●Cb0.05000mol/L ·由于CbKb>20Kw,CbKb>500,可以用最简式 [OH ]=KC.= KwCp K 1.00×10日4 176x10sX5.00x102=5.4x10(moM p0H=5.28,pH=8.72
3. 化学计量点时(Va = Vb =20.00 ml) 5.00 10 5.4 10 (mol/L ) 1.76 10 1.00 10 C K K O H K C 2 6 5 1 4 b a w b b − − − − − = = = = ⚫Kb= Kw/Ka=10-14/1.76×10-5=5.68 ×10-10 ⚫Cb=0.05000 mol/L ⚫由于CbKb >20Kw,Cb /Kb >500,可以用最简式 pOH=5.28,p H=8.72 溶液组成: NaAc 溶液的pH值由 Ac-的水解决定, 用一元弱碱的公式计算

4.化学计量点后(Vb>Va) 溶液组成NaAc十NaOH NaOH抑制了Ac的水解,溶液pH值取决于过量的NaOH的浓度, 计算方法与强酸强碱相同。 Vb=20.02ml p0H=4.30 ·pH=9.70
4.化学计量点后(Vb >Va) •Vb=20.02 ml •pOH=4.30 • p H=9.70 NaOH抑制了Ac-的水解,溶液 pH值取决于过量的 NaOH的浓度, 计算方法与强酸强碱相同。 溶液组成 NaAc + NaOH
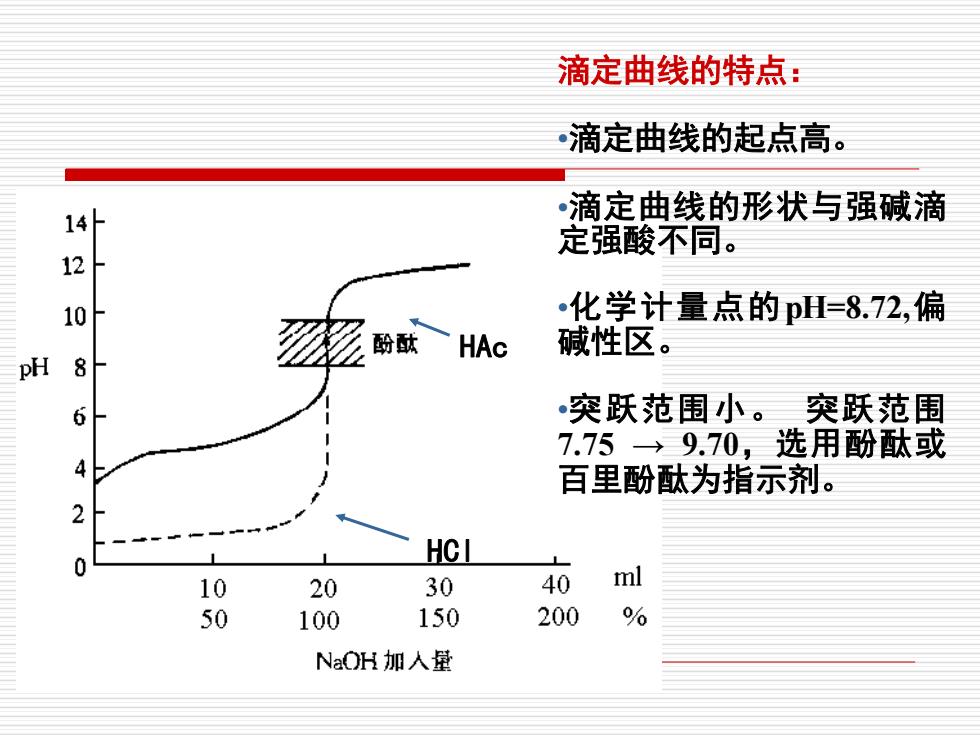
滴定曲线的特点: 滴定曲线的起点高。 ·滴定曲线的形状与强碱滴 定强酸不同。 10 •化学计量点的pH=8.72,偏 酚酞HAC 碱性区。 PH 8 6 突跃范围小。突跃范围 7.75→9.70,选用酚酞或 百里酚酞为指示剂。 2 HCI 0 10 20 30 40 ml 50 100 150 200 % NaOH加人量
HCl HAc 滴定曲线的特点: •滴定曲线的起点高。 •滴定曲线的形状与强碱滴 定强酸不同。 •化学计量点的pH=8.72,偏 碱性区。 •突跃范围小。 突跃范围 7.75 → 9.70,选用酚酞或 百里酚酞为指示剂
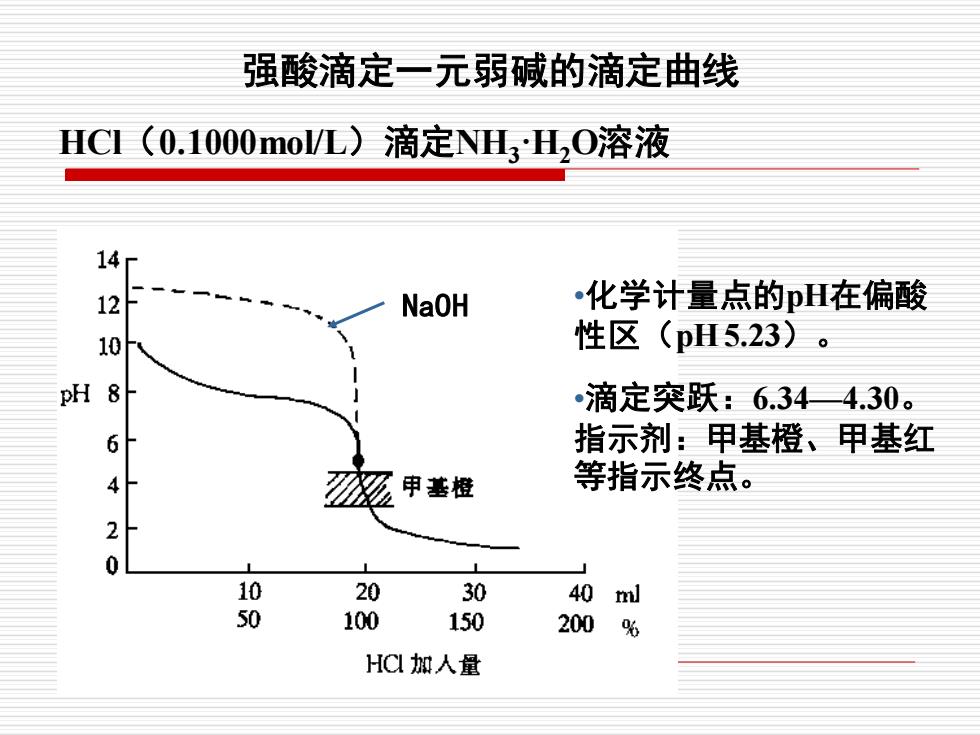
强酸滴定一元弱碱的滴定曲线 HC(0.1000mo/L)滴定NHH,O溶液 1420 NaOH 化学计量点的pH在偏酸 性区(pH5.23)。 8 滴定突跃:6.34—4.30。 6 指示剂:甲基橙、甲基红 4 逐 申基橙 等指示终点。 0 10 20 30 40 l 50 100 150 200 % HC加人量
HCl(0.1000mol/L)滴定NH3·H2O溶液 强酸滴定一元弱碱的滴定曲线 NaOH •化学计量点的pH在偏酸 性区(pH 5.23)。 •滴定突跃:6.34—4.30。 指示剂:甲基橙、甲基红 等指示终点