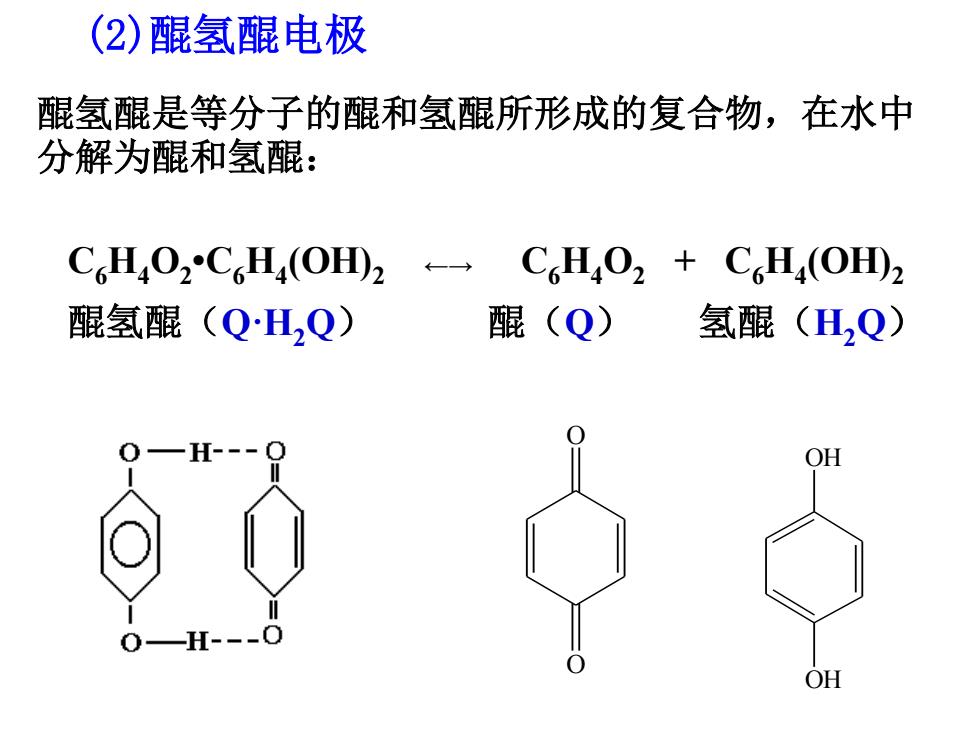
(2)醌氢醌电极 醌氢醌是等分子的醌和氢醌所形成的复合物,在水中 分解为醌和氢醌: C6H402C6H4(OHD2←→ C6H4O2+C6H4(O田2 醌氢醌(QH,Q) 醌(Q) 氢醌(H,Q) O一H- OH 0-H-0 OH
(2)醌氢醌电极 醌氢醌是等分子的醌和氢醌所形成的复合物,在水中 分解为醌和氢醌: C6H4O2 •C6H4 (OH)2 ←→ C6H4O2 + C6H4 (OH)2 醌氢醌(Q·H2Q) 醌(Q) 氢醌(H2Q) O O OH OH

电极:Pt|Q、HQ、H 电极反应:CH4O2+2Ht+2e→C6H4(OHD2 =E RT In caucnRTm-0.05916pl 2F dc.r 2F“ (ac4o=4cH,0,) 应用:用于测溶液的pH值(pH<8.5)
应用:用于测溶液的pH值( pH <8.5) 电极:Pt┃ Q、 H2Q、 H+ 电极反应:C6H4O2 + 2 H+ +2e C6H4 (OH)2

四、Gibbs自由能与可逆电池的电动势 热力学第二定律 ·等温等压下体系吉布斯自由能的减少量不少 于体系所作的非膨胀功。 -△Gx,P≥W 等号表示可逆过程: -△GT,P=W,max
四、Gibbs自由能与可逆电池的电动势 热力学第二定律 GT,P Wf •等温等压下体系吉布斯自由能的减少量不少 于体系所作的非膨胀功。 GT,P Wf ,max •等号表示可逆过程:

对于电池,非体积功只有电功。 因此恒温恒压下,对于可逆电池,可以建立起 电池的摩尔反应吉布斯自由能与原电池可逆电 动势的关系。 法拉第电解定律 电池在发生反应过程中释放的电荷量与反应 进度之间有如下关系 O=ZFS
对于电池,非体积功只有电功。 因此恒温恒压下,对于可逆电池,可以建立起 电池的摩尔反应吉布斯自由能与原电池可逆电 动势的关系。 法拉第电解定律 电池在发生反应过程中释放的电荷量与反应 进度之间有如下关系 Q zF

电池放电过程所做的电功 δW=E·dQ=zFEdξ 当反应进度为1mol时,电池所做的电功 W=ZEF
W EdQ zFEd 电池放电过程所做的电功 当反应进度为1mol时,电池所做的电功 W zEF f =