
药物分析2010 年执业药师药物分析基础班文字讲义换算因数:待测组分的分子量(或原子量)与称量形式的分子量的比值。乘适当系数,使分子分母中所含待测成分的原子数或分子数相等。换算因数=被测组分/称量形式A型题:被测物 MgO的沉淀形式为MgNHaP04,称量形式为Mg.P:0,其换算因数为A. Mg0/MgNH,PO.B. MgNH,PO./Mg.P:0. yaoq.netC. Mg0/Mg.P20,D. 2Mg0/Mg-P207E. Mg.P20./Mg0@【答疑编号111040101]『正确答案」 DA型题:称量形式A.供试液与适当的沉淀剂作用产生的沉淀组成B.被测物的组成/称量形式C.沉淀经过滤、洗涤、干燥后的化学组成D.称量形式/被测物分子量E.被测量物与沉淀分子量的比值[答疑编号111040102]W.「正确答案』C第二节 酸碱滴定法补充内容:滴定口滴定:将标准溶液逐滴加入被分析溶液中,用颜色变化、沉淀或电导率变化等来确定反应的终点。更多的时候是用颜色来确定反应终点。滴定管:酸式滴定管(活塞式)、碱式滴定管(胶皮管式)什么时候用酸式滴定管,什么时候用碱式滴定管??药圈 wwyaaq.net 会员分享 仅供个人学习使用严禁用于商业第26页
2010 年执业药师药物分析基础班文字讲义 药物分析 药圈 www.yaoq.net 会员分享 仅供个人学习使用严禁用于商业 第 26 页 换算因数:待测组分的分子量(或原子量)与称量形式的分子量的比值。乘适当系数,使分子分母中所含待测成分 的原子数或分子数相等。 换算因数=被测组分/称量形式 A 型题: 被测物 MgO 的沉淀形式为 MgNH4PO4,称量形式为 Mg2P2O7,其换算因数为 A.MgO/MgNH4PO4 B.MgNH4PO4/Mg2P2O7 C.MgO/Mg2P2O7 D.2MgO/Mg2P2O7 E.Mg2P2O7/MgO [答疑编号 111040101] 『正确答案』D A 型题: 称量形式 A.供试液与适当的沉淀剂作用产生的沉淀组成 B.被测物的组成/称量形式 C.沉淀经过滤、洗涤、干燥后的化学组成 D.称量形式/被测物分子量 E.被测量物与沉淀分子量的比值 [答疑编号 111040102] 『正确答案』C 第二节 酸碱滴定法 补充内容:滴定 滴定:将标准溶液逐滴加入被分析溶液中,用颜色变化、沉淀或电导率变化等来确定反应的终点。更多的时候是用 颜色来确定反应终点。 滴定管:酸式滴定管(活塞式)、碱式滴定管(胶皮管式) 什么时候用酸式滴定管,什么时候用碱式滴定管??

药物分析2010年执业药师药物分析基础班文字讲义大部分滴定都用酸式滴定管,只有涉及到碱性溶液时采用碱式滴定管。原因是,碱性溶液会和玻璃发生反应,产生粘连疑问?用颜色判断的终点和按化学反应式计算的终点有什么不同?NaOH+HC1——H0O+NaC计算判断终点-化学计量点:按化学反应关系求得的理论值(等当点)颜色判断终点滴定终点:滴定时,指示剂改变颜色的那一理论与实际的差别。在实验中,我们只能得到存在误差的滴定终点,而不能得到确切的化学计量点。(真实值与测量值的差别)Xne.指示剂:用于指示滴定终点的试剂。酸碱指示剂、氧化还原指示剂、沉淀指示剂重点:(1)滴定方法:强酸强碱滴定、强酸滴定弱碱、强碱滴定弱酸、多元酸滴定(2)滴定液的配制和标定:常用滴定液及变色范围(3)应用:利用滴定方法测定物质含量酸:在水溶液里能产生 H 的物质,HC1、HAc。pH<7 碱:在水溶液里能产生 OH的物质,NaOH、KOH。DH>7酸碱滴定:利用酸和碱在水溶液中的中和反应进行滴定的分析方法叫酸碱滴定法,一、 强酸强碱滴定1、滴定原理H+ +OH H,O滴定反应为:2、滴定过程(以 NaOH滴定HC1 为例)药圈www.yaoq.net会员分享仅供个人学习使用严禁用于商业第27页
2010 年执业药师药物分析基础班文字讲义 药物分析 药圈 www.yaoq.net 会员分享 仅供个人学习使用严禁用于商业 第 27 页 大部分滴定都用酸式滴定管,只有涉及到碱性溶液时采用碱式滴定管。原因是,碱性溶液会和玻璃发生反应,产生 粘连。 疑问?用颜色判断的终点和按化学反应式计算的终点有什么不同? NaOH+HCl——H2O+NaCl 计算判断终点——化学计量点:按化学反应关系求得的理论值(等当点) 颜色判断终点——滴定终点:滴定时,指示剂改变颜色的那一点 理论与实际的差别。在实验中,我们只能得到存在误差的滴定终点,而不能得到确切的化学计量点。(真实值与测 量值的差别) 指示剂:用于指示滴定终点的试剂。酸碱指示剂、氧化还原指示剂、沉淀指示剂 重点: (1)滴定方法:强酸强碱滴定、强酸滴定弱碱、强碱滴定弱酸、多元酸滴定 (2)滴定液的配制和标定:常用滴定液及变色范围 (3)应用:利用滴定方法测定物质含量 酸:在水溶液里能产生 H 的物质,HCl、HAc。pH<7 碱:在水溶液里能产生 OH 的物质,NaOH、KOH。pH>7 酸碱滴定:利用酸和碱在水溶液中的中和反应进行滴定的分析方法叫酸碱滴定法。 一、强酸强碱滴定 1、滴定原理 滴定反应为: 2、滴定过程(以 NaOH 滴定 HCl 为例)

药物分析2010 年执业药师药物分析基础班文字讲义14h10FpH st化学计量点6F4盈net21OL08aoq.图4-1NaOH波(0.1000mo/L)滴定HCI液(0.1000mal/L)20.00ml的滴定曲线A.甲基橙B.酸(1)滴定过程pH 的变化:滴定开始前 pH=1.00接近滴定终点时pH增大,接近7化学计量点时 pH=7.00滴入过量的NaOH后pH大于 7(2)在化学计量点附近滴入NaOH的体积有个很小的变化,会引起PH很大的变化。—滴定突跃滴定突跃:在化学计量点前后土0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱滴定中的pH)的突然改变就是滴定突跃,突跃所在的范围称为突跃范围。3、指示剂的选择选择的依据:滴定突跃是选择指示剂的重要依据,凡是变色范围全部或部分落在滴定突跃范围内的指示剂都可用来指示滴定终点。用强碱滴定强酸可选择的指示剂:酚酰(甲基红、甲基橙)掌握重点1、 化学计量点时 pH-72、实跃范围:4.30-9.70 (陪越酸碱范围)3、择指示剂、酚、甲基红、甲基检二、强碱滴定弱酸 (NaOH 滴定醋酸)弱酸:不能完全解离成H的酸药圈www.vaoa.net会员分享仅供个人学习使用严禁用于商业第28页
2010 年执业药师药物分析基础班文字讲义 药物分析 药圈 www.yaoq.net 会员分享 仅供个人学习使用严禁用于商业 第 28 页 (1)滴定过程 pH 的变化: 滴定开始前 pH=1.00 接近滴定终点时 pH 增大,接近 7 化学计量点时 pH=7.00 滴入过量的 NaOH 后 pH 大于 7 (2)在化学计量点附近 滴入 NaOH 的体积有个很小的变化,会引起 PH 很大的变化。——滴定突跃 滴定突跃:在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱 滴定中的 pH)的突然改变就是滴定突跃,突跃所在的范围称为突跃范围。 3、指示剂的选择 选择的依据:滴定突跃是选择指示剂的重要依据,凡是变色范围全部或部分落在滴定突跃范围内的指示剂都可用来 指示滴定终点。 用强碱滴定强酸可选择的指示剂:酚酞(甲基红、甲基橙) 二、强碱滴定弱酸(NaOH 滴定醋酸) 弱酸:不能完全解离成 H 的酸
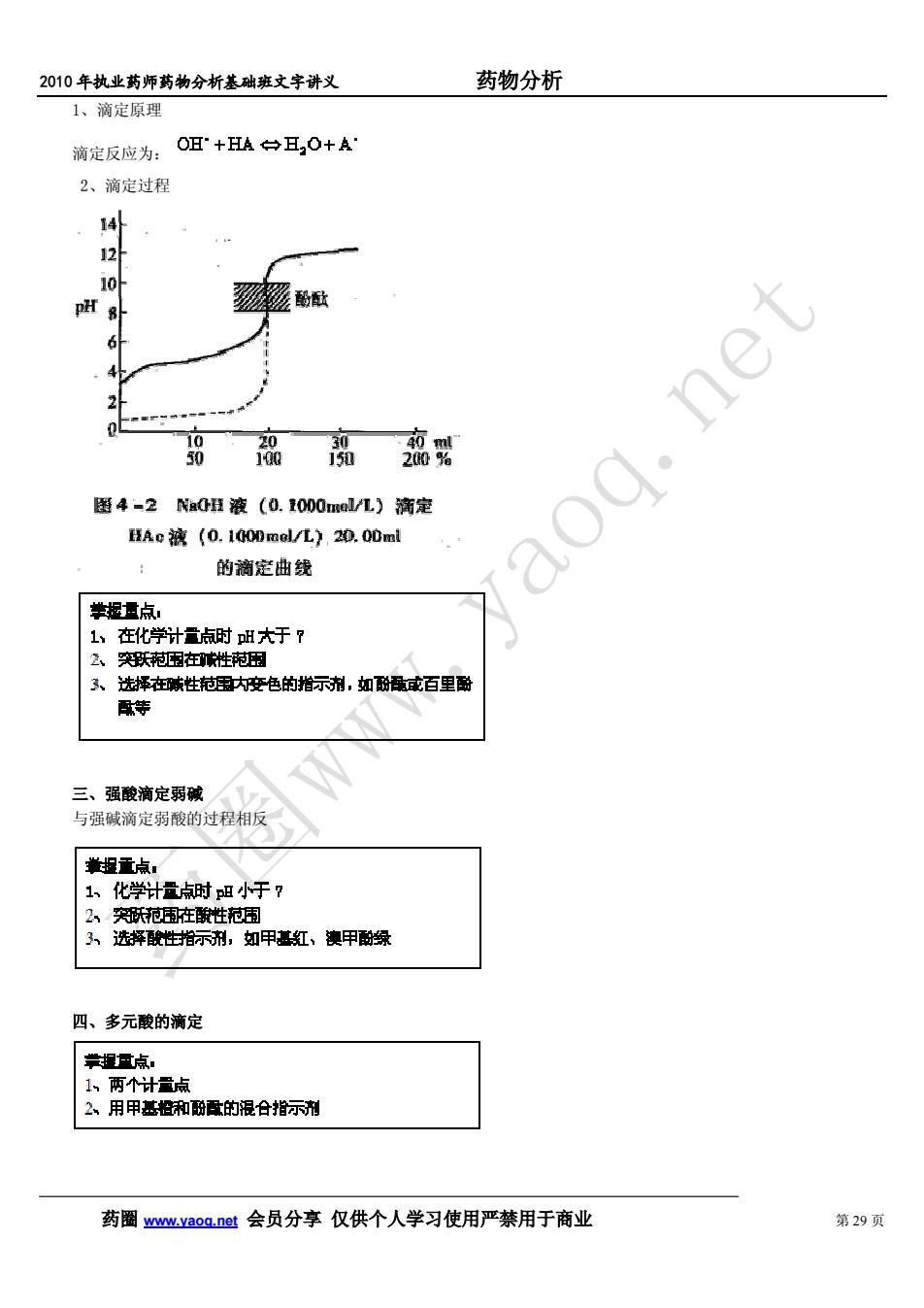
药物分析2010年执业药师药物分析基础班文字讲义1、滴定原理滴定反应为:OH"+HA耳,O+A:2、滴定过程14pHr sfaoq.netsf20.9200图4-2NaOH液(0.1000mol/L)滴定HAo 液 (0. 1000mel/L),20. 00ml的商定曲线学提量点1、 在化学计量点时 H 大于 72、突跃范围在碱性范围3、 选择在嗽性范围内变色的指示剂,如酚骼或百里酚配等三、 强酸滴定弱碱与强碱滴定弱酸的过程相反举报重点1、 化学计量点时 p 小于 72、突既范围在酸性范围3、选择酸性指示剂,如甲基红、澳甲酚绿四、多元酸的滴定掌提量点。1、两个计量点2.、 用甲基检和酚酸的混合指示剂药圈www.vaoq.net会员分享仅供个人学习使用严禁用于商业第29页
2010 年执业药师药物分析基础班文字讲义 药物分析 药圈 www.yaoq.net 会员分享 仅供个人学习使用严禁用于商业 第 29 页 1、滴定原理 滴定反应为: 2、滴定过程 三、强酸滴定弱碱 与强碱滴定弱酸的过程相反 四、多元酸的滴定

药物分析2010 年执业药师药物分析基础班文字讲义五、滴定液的配制和标定最常使用的酸滴定液是硫酸滴定液和盐酸滴定液,碱滴定液是氢氧化钠滴定液《中国药典》采用间接法配制滴定液,即先配制成大致浓度的溶液,然后再用基准物标定,以确定滴定液的准确浓度。滴定液的浓度一般在0.01~1mo1/L之间,最常使用的是0.1mo1/L的浓度。问题:为什么用间接法而不用直接法配置?net常用基准物:酸滴定液配置常用基准物为无水碳酸钠碱滴定液配置常用基准物为邻苯二甲酸氢钾六、酸碱滴定法的应用1.直接滴定法yaoq.2.间接滴定法历年考点:1、化学计量点、滴定终点的概念2、几种常见酸碱滴定的突跃范围3、滴定液及指示剂选择4、根据酸碱滴定计算含量A型题:用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH值是A. 1. 00~3. 00B. 3. 00~4. 30WWC. 4. 30~9. 70D. 8. 00~9. 70E. 9. 70~10. 060[答疑编号 111040103]「正确答案CA 型题:滴定分析中,一般利用指示剂的突变来判断化学计量点的到达,在指示剂变色时停止滴定,这一点为A.化学计量点B. 滴定分析C.滴定等当点D.滴定终点E.滴定误差[答疑编号111040104]「『正确答案」D药圈 wwyaaq.net 会员分享 仅供个人学习使用严禁用于商业第30页
2010 年执业药师药物分析基础班文字讲义 药物分析 药圈 www.yaoq.net 会员分享 仅供个人学习使用严禁用于商业 第 30 页 五、滴定液的配制和标定 最常使用的酸滴定液是硫酸滴定液和盐酸滴定液,碱滴定液是氢氧化钠滴定液。 《中国药典》采用间接法配制滴定液,即先配制成大致浓度的溶液,然后再用基准物标定,以确定滴定液的准确浓 度。滴定液的浓度一般在 0.01~1mol/L 之间,最常使用的是 0.1mol/L 的浓度。 问题:为什么用间接法而不用直接法配置? 常用基准物: 酸滴定液配置常用基准物为无水碳酸钠 碱滴定液配置常用基准物为邻苯二甲酸氢钾 六、酸碱滴定法的应用 1.直接滴定法 2.间接滴定法 历年考点: 1、化学计量点、滴定终点的概念 2、几种常见酸碱滴定的突跃范围 3、滴定液及指示剂选择 4、根据酸碱滴定计算含量 A 型题: 用氢氧化钠滴定液(0.1000mol/L)滴定 20.00ml 盐酸溶液(0.1000mol/L),滴定突跃范围的 pH 值是 A.1.00~3.00 B.3.00~4.30 C.4.30~9.70 D.8.00~9.70 E.9.70~10.00 [答疑编号 111040103] 『正确答案』C A 型题: 滴定分析中,一般利用指示剂的突变来判断化学计量点的到达,在指示剂变色时停止滴定,这一点为 A.化学计量点 B.滴定分析 C.滴定等当点 D.滴定终点 E.滴定误差 [答疑编号 111040104] 『正确答案』D