
第二节配合物的化学键理论 中心原子的杂化轨道类型和配合物的空间构型 配位数杂化轨道 空间构型 实例 2 sp 直线 [AgNH3)2]、[Au(CN)2] 4 Sp3 四面体 Ni(CO)4]、[ZnC4]2 dsp2 平面四方形 [Ni(CN)4]2-、[PtC4]2 6 sp3d2 八面体 [FeF6]3-、[CoNH3)6]2+ d2sp3 八面体 [Fe(CN)6]3-、[Co(NH3)6]3+
第二节 配合物的化学键理论 中心原子的杂化轨道类型和配合物的空间构型 配位数 杂化轨道 空间构型 实 例 2 sp 直线 [Ag(NH3 ) 2 ] + 、 [Au(CN)2 ] - 4 sp3 四面体 [Ni(CO)4 ] 、 [ZnCl4 ] 2- dsp2 平面四方形 [Ni(CN)4 ] 2-、[PtCl4 ] 2- 6 sp3d 2 八面体 [FeF6 ] 3-、 [Co(NH3 ) 6 ] 2+ d 2 sp3 八面体 [Fe(CN)6 ] 3-、[Co(NH3 ) 6 ] 3+

第二节配合物的化学键理论 2.外轨配合物和内轨配合物 ①外轨配合物(outer-orbital coordination compound):中心原子全部用最外层价电子空 轨道(ns、np、nd)进行杂化成键所形成的配合 物
第二节 配合物的化学键理论 2. 外轨配合物和内轨配合物 ① 外轨配合物(outer-orbital coordination compound) :中心原子全部用最外层价电子空 轨道(ns、np、nd)进行杂化成键所形成的配合 物
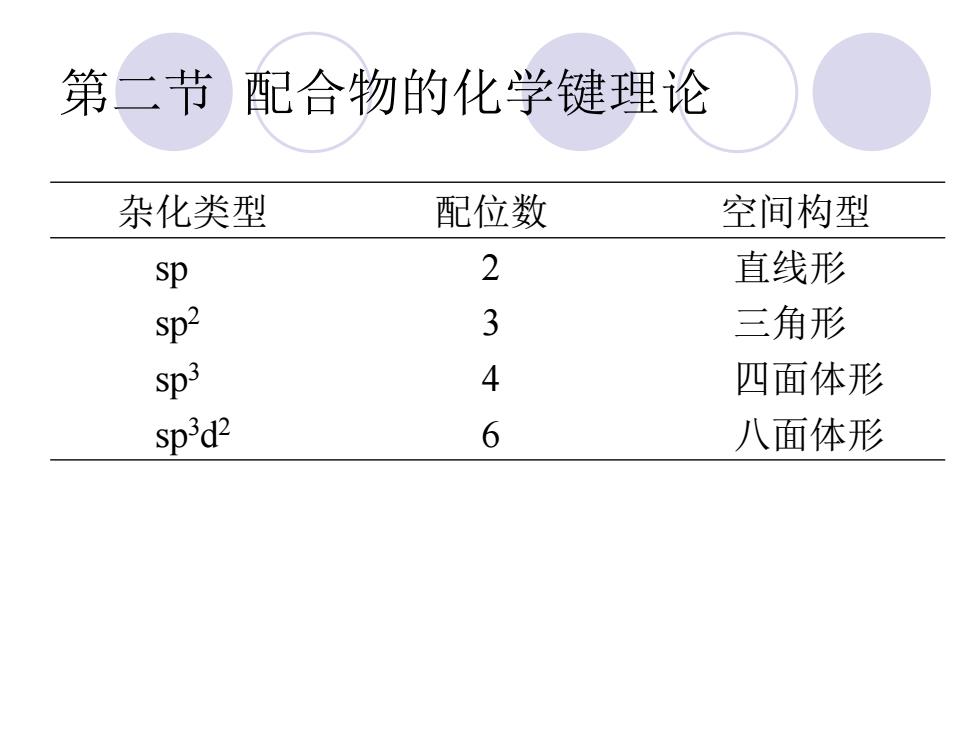
第二节配合物的化学键理论 杂化类型 配位数 空间构型 sp 2 直线形 sp2 3 三角形 sp3 4 四面体形 sp'd2 6 八面体形
杂化类型 配位数 空间构型 sp 2 直线形 sp2 3 三角形 sp3 4 四面体形 sp3d 2 6 八面体形 第二节 配合物的化学键理论
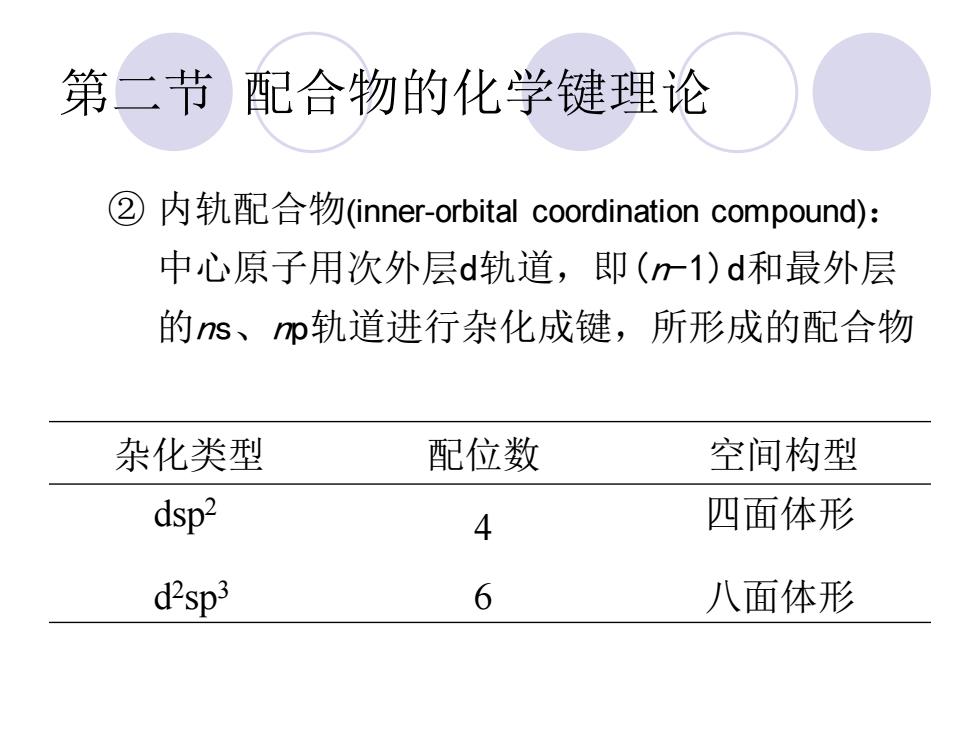
第二节配合物的化学键理论 ② 内轨配合物(inner-orbital coordination compound): 中心原子用次外层d轨道,即()d和最外层 的s、心轨道进行杂化成键,所形成的配合物 杂化类型 配位数 空间构型 dsp2 4 四面体形 d"sp3 6 八面体形
第二节 配合物的化学键理论 ② 内轨配合物(inner-orbital coordination compound): 中心原子用次外层d轨道,即(n-1)d和最外层 的ns、np轨道进行杂化成键,所形成的配合物 杂化类型 配位数 空间构型 dsp2 4 四面体形 d 2 sp3 6 八面体形

第二节配合物的化学键理论 3.实例 ①配位数为2的配合物 [AgNH3)2]十的形成 Ag*的电子组态:[Kr]4d1o
第二节 配合物的化学键理论 3. 实例 ① 配位数为2的配合物 [Ag(NH3 )2 ] +的形成 Ag+的电子组态: [Kr] 4d10