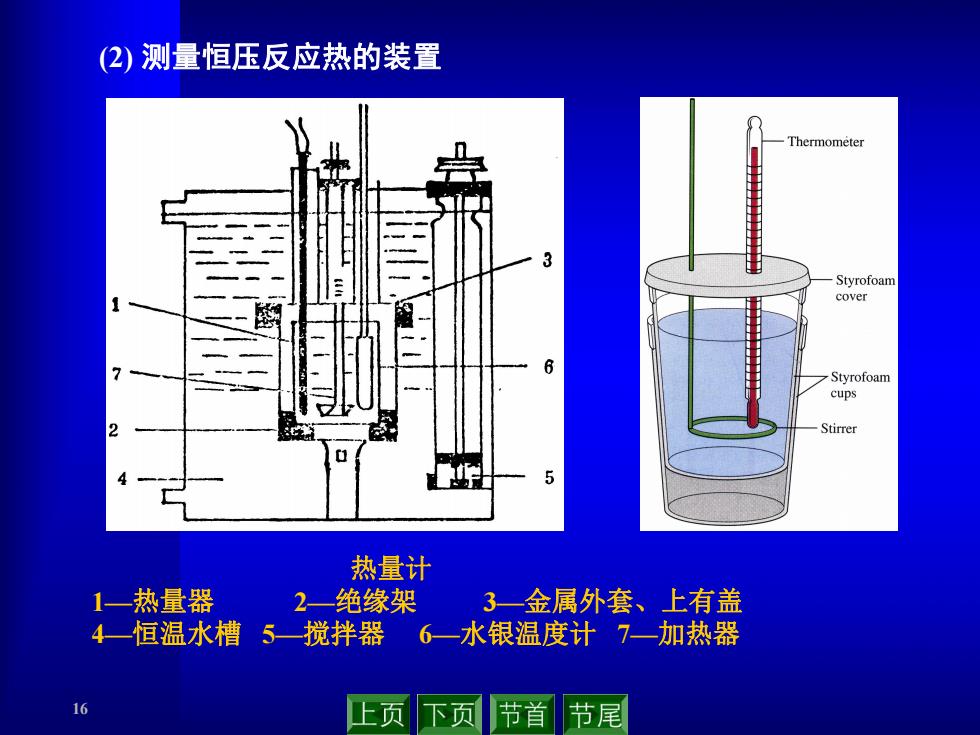
(2)测量恒压反应热的装置 Thermometer 3 Styrofoam cover cups Stirrer 5 热量计 1一热量器 2-绝缘架 3一金属外套、上有盖 4一恒温水槽5—搅拌器 6一水银温度计7一加热器 上页下页 节首节尾
16 (2) 测量恒压反应热的装置 热量计 1—热量器 2—绝缘架 3—金属外套、上有盖 4—恒温水槽 5—搅拌器 6—水银温度计 7—加热器

4.2.5.热化学方程式(thermochemical equation) ()热化学方程式表示化学反应及其反应热关系的化学反应方程式 2H2g)+O,g)→>2HOg, △.H(298.15K)=-483.64kJ.molr' △H称为反应的标准摩尔焓变 要注意到△H值一定要与化学方程式相对应,单位中的“mol-1” 是指“每摩尔反应”而不是指“每摩尔反应物”, 聚集状态不同时,△H不同 2H2(g)+02(g)=2H20(0① △,H(298.15K)=-571.66 kJ.mol 化学计量数不同时,△H不同 H2(g)+O2(g)-H2O(g) △H(298.15K)=-241.82kJ.mol 12 正页下页节首节尾
17 (1) 热化学方程式 表示化学反应及其反 应热关系的化学反应方程式 θ -1 r m 2 2 2 298.15K 483.64kJ mol 2H g O g 2H O g H 称为反应的标准摩尔焓变 4.2.5. 热化学方程式 (thermochemical equation) θ rHm 要注意到 值一定要与化学方程式相对应,单位中的“mol-1” 是指“每摩尔反应”而不是指“每摩尔反应物”. rH θ -1 r m 2 2 2 298.15K 571.66 kJ mol 2H (g) O (g) 2H O (l) H θ -1 r m 2 2 2 298.15K 241.82kJ mol O g H O g 2 1 H g H 聚集状态不同时,rH m θ 不同 化学计量数不同时,rH m θ 不同

一个非常重要的问题! (2)标准状态 热力学中指的标准状态与讨论气体时,经常用到 的标准状况是不一样的。 气体 T,p=po =100kPa 液,固体 T,p,纯物质 溶液,溶质 B,bg=b9=1mol·kg1 CB≈c=1mol·L1 18 上页下页 节首 节尾
18 气体 T,p = pq =100kPa 液,固体 T,p,纯物质 溶液,溶质 B,bB = b q = 1mol · kg -1 cB ≈ c = 1mol · L-1 一个非常重要的问题! (2)标准状态 热力学中指的标准状态与讨论气体时,经常用到 的标准状况是不一样的

4.3焓和焓变(enthalpy&enthalpy changes) 4.3.1焓和焓变(Enthalpy&enthalpy changes) ●对于封闭系统,在恒容过程中, △=0,W=0 Q,=△UQ为恒容反应热 ●在恒压过程中 AU=Q。-P✉△7 U2-Uj=C,-Pe(V-V) U2-U=Cp-(p2V-pV) Qp=(U2+p2'2)-U+pY) 焓:H=U+p 烙变:Qp=H2-H1=△H 吸热反应△H>0,放热反应△H<O 19 上页下页 节首节尾
19 4.3 焓和焓变 (enthalpy & enthalpy changes) 4.3.1 焓和焓变 (Enthalpy & enthalpy changes) ● 对于封闭系统,在恒容过程中 QV U QV为恒容反应热 2 2 2 1 1 1 2 1 2 2 1 1 2 1 2 1 Q (U p V ) U p V U U Q p V p V U U Q p V V U Q p V p p p ex p ex Qp H2 H1 H 吸热反应H 0,放热反应H 0 ● 在恒压过程中 焓: 焓变: H U pV

4.3.2.△r0m与△rHm的关系 (relationship between△rUm and△rHm) △U=Q+W △U=△H-Pex△V 对无气体参加的反应:W=P△=0 △Hm=AUm 对有气体参加的反应:△Um=△,Hm-Pex△ =△rHm-△ng)R7 =△,Hm-RT>p(g ≈△,Hm 20 上页下页节首节尾
20 对无气体参加的反应: W = –pex V=0 对有气体参加的反应: U H p V U Q W ex rHm rUm rUm rHm pexV r m r m B r m (g) g H H RT v H n RT 4.3.2. rUm与rHm 的关系 (relationship between rUm and rHm )