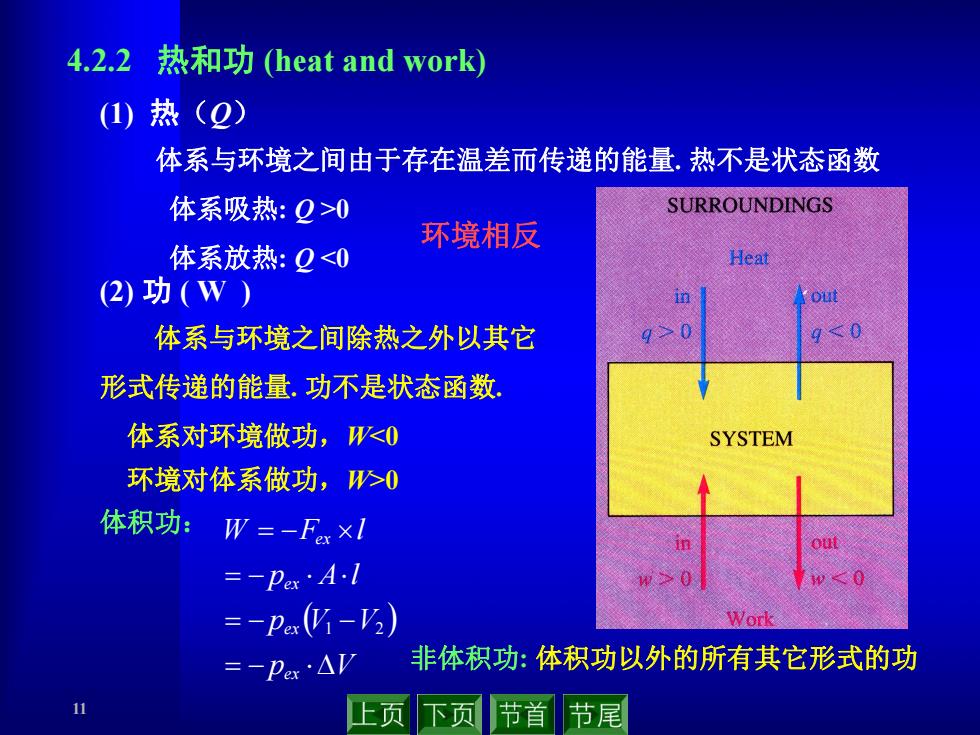
4.2.2热和功(heat and work (1)热(2) 体系与环境之间由于存在温差而传递的能量,热不是状态函数 体系吸热:Q>0 SURROUNDINGS 环境相反 体系放热:Q<0 Heat (2)功(W) 体系与环境之间除热之外以其它 90 0 形式传递的能量.功不是状态函数, 体系对环境做功,W<0 SYSTEM 环境对体系做功,>0 体积功: W=-Fx×l =-pex·Al 0 =-Pa(V-V2) Work =-pex·△ 非体积功:体积功以外的所有其它形式的功 上页 下页 节首节尾
11 体系与环境之间由于存在温差而传递的能量. 热不是状态函数 体系吸热: Q >0 体系放热: Q <0 (1) 热(Q) 4.2.2 热和功 (heat and work) 环境相反 体系与环境之间除热之外以其它 形式传递的能量. 功不是状态函数. 体系对环境做功,W<0 环境对体系做功,W>0 体积功: p V p V V p A l W F l ex ex ex ex 1 2 非体积功: 体积功以外的所有其它形式的功 (2) 功 ( W )

4.2.3 热力学能(thermodynamic energy) (1)热力学能(心:体系内所有微观粒子的全部能量之和,旧称内能, 是状态函数,热力学能变化只与始态、终态有关,与变化途径无 关.至今尚无法直接测定,只能测定到△山 U2-U1=△U (2)热力学第一定律 热力学第一定律的实质是能量守恒与转化定律 U 吸热Q→U2 得功W U2 =U +Q+W U,-U=Q+W 对于封闭体系热力学第一定律为: △U=Q+W 上页 下页 节首 节尾
12 (1) 热力学能 (U): 体系内所有微观粒子的全部能量之和,旧称内能, U是状态函数,热力学能变化只与始态、终态有关,与变化途径无 关. 至今尚无法直接测定,只能测定到 U. U2 U1 U 4.2.3 热力学能 (thermodynamic energy) U Q W 对于封闭体系热力学第一定律为: U2 U1 Q W U2 U1 Q W 2 Q U1 U 吸热 得功W (2) 热力学第一定律 热力学第一定律的实质是能量守恒与转化定律
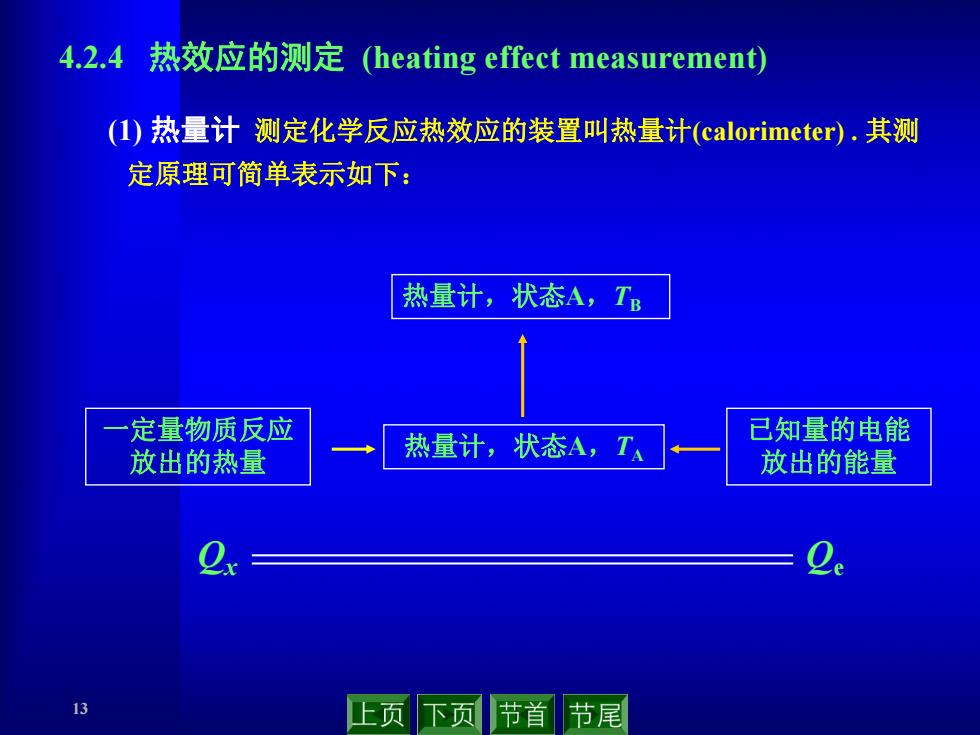
4.2.4热效应的测定(heating effect measurement) (1)热量计测定化学反应热效应的装置叫热量计(calorimeter).其测 定原理可简单表示如下: 热量计,状态A,TB 定量物质反应 已知量的电能 放出的热量 热量计,状态A,T· 放出的能量 13 止页下页节首 节尾
13 (1) 热量计 测定化学反应热效应的装置叫热量计(calorimeter) . 其测 定原理可简单表示如下: 4.2.4 热效应的测定 (heating effect measurement) Qx Qe 一定量物质反应 放出的热量 已知量的电能 放出的能量 热量计,状态A,TB 热量计,状态A,TA

(2)测量恒容反应热的装置 Ignition wires Thermometer Stirrer Insulating container Steel bomb Reactants Water in sample cup 14 上页下页节首节尾
14 (2) 测量恒容反应热的装置

量热常数(calorimeter constant) 代表弹液(如水)和与之相接触的热量计部件(如杯体、钢弹、温度 计、搅拌棒、 和引燃丝等)热容之和.(例如盛水2000g的弹式热量计的 常数为10.1kJK Example 3 0.640g萘(C1Hg)在热量计常数为10.1kJK1的热量计中 燃烧使水温上升2.54K,求萘的燃烧热. Solution Q=2.54K×10.1 kJ.mol-1=25.7kJ 25.7kJ △E= 0.640g ×128gmol1=5.14×103 kJ-mol- 15 上页 下页 节首 节尾
15 0.640 g 萘(C10H8)在热量计常数为 10.1 kJ·K-1 的热量计中 燃烧使水温上升 2.54 K,求萘的燃烧热. Solution Q = 2.54 K × 10.1 kJ·mol -1 = 25.7 kJ 0.640g 25.7kJ E ×128 g ·mol -1 = 5.14 × 103 kJ·mol -1 代表弹液(如水)和与之相接触的热量计部件(如杯体﹑钢弹﹑ 温度 计﹑ 搅拌棒﹑ 和引燃丝等)热容之和.(例如盛水2000g的弹式热量计的 常数为10.1 kJ·K-1) 量热常数(calorimeter constant) Example 3