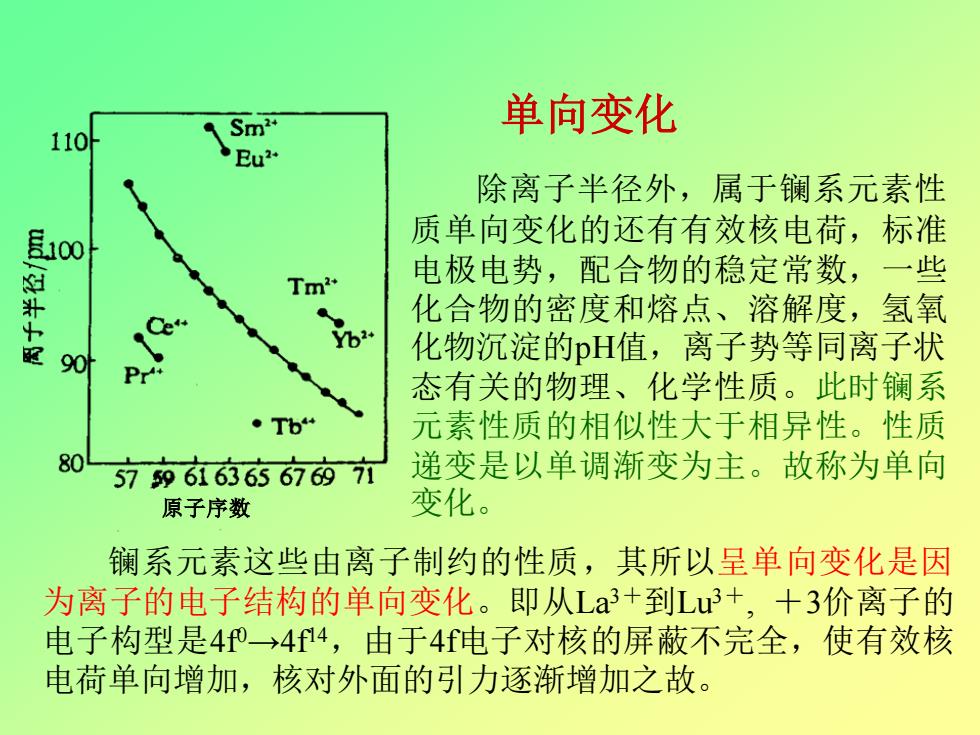
单向变化 110 Sm2 Eu2 除离子半径外,属于镧系元素性 100 质单向变化的还有有效核电荷,标准 电极电势,配合物的稳定常数,一些 化合物的密度和熔点、溶解度,氢氧 e 配 90 化物沉淀的pH值,离子势等同离子状 Pr 态有关的物理、化学性质。此时镧系 Tb 元素性质的相似性大于相异性。性质 80 5796i636$67内7 递变是以单调渐变为主。故称为单向 原子序数 变化。 镧系元素这些由离子制约的性质,其所以呈单向变化是因 为离子的电子结构的单向变化。即从La3+到Lu3+,+3价离子的 电子构型是40→4f4,由于4f电子对核的屏蔽不完全,使有效核 电荷单向增加,核对外面的力逐渐增加之故
除离子半径外,属于镧系元素性 质单向变化的还有有效核电荷,标准 电极电势,配合物的稳定常数,一些 化合物的密度和熔点、溶解度,氢氧 化物沉淀的pH值,离子势等同离子状 态有关的物理、化学性质。此时镧系 元素性质的相似性大于相异性。性质 递变是以单调渐变为主。故称为单向 变化。 单向变化 原子序数 镧系元素这些由离子制约的性质,其所以呈单向变化是因 为离子的电子结构的单向变化。即从La3+到Lu3+ , +3价离子的 电子构型是4f 0→4f 14 ,由于4f电子对核的屏蔽不完全,使有效核 电荷单向增加,核对外面的引力逐渐增加之故

Gd断效应 在镧系元素的离子半径的变化中,在具有f的中点64Gd3+处 微有不连续性,由其相邻离子半径的差值的大小可以看出: Pm3+Sm3+ Eu3+Gd3+Tb3+Dy3+ r/pm 97.996.495.093.892.390.8 M 稳 △/pm 1.5 1.4 1.2 1.51.5 类似的现象还出现在镧系元素的 配位化合物的稳定常数中。 64Gd 这种现象被称之为Gd断效应。 原子序数 64Gd位于15个镧系元素所构成的序列的正中央,其十3 价离子有半充满的?稳定结构,这种结构的电子屏蔽效应 大,有效核电荷相对较小,从而使半径收缩幅度减小,碱 度增加,导致配合物稳定常数等性质有所降低,从而出现 Gd断的现象
Gd断效应 64Gd位于15个镧系元素所构成的序列的正中央,其+3 价离子有半充满的f 7稳定结构,这种结构的电子屏蔽效应 大,有效核电荷相对较小,从而使半径收缩幅度减小,碱 度增加,导致配合物稳定常数等性质有所降低,从而出现 Gd断的现象。 类似的现象还出现在镧系元素的 配位化合物的稳定常数中。 这种现象被称之为Gd断效应。 在镧系元素的离子半径的变化中,在具有f 7的中点64Gd3+处 微有不连续性, 由其相邻离子半径的差值的大小可以看出: Pm3+ Sm3+ Eu3+ Gd3+ Tb3+ Dy3+ r/pm 97.9 96.4 95.0 93.8 92.3 90.8 rM 3+ K稳 △/pm 1.5 1.4 1.2 1.5 1.5 原子序数 64Gd

4Ln3+离子的碱度 某种金属离子吸引电子或阴离子的能力被称为该金属 离子的“相对碱度”。引力越强,诚度越强。 碱度的强弱可用金属离子的离子势o(=Z)来量度,盛 子势值越大即半径小,电荷高则诚度越弱。 对于镧系电荷相同的离子,随着原子序数增加,离子半 径减小,离子势逐渐增大,离子的碱度减弱。 碱度呈现单向变化的规律。 利用Ln3+离子半径的微小差别,亦即碱度的微小差别, 可以对镧系离子进行分离
某种金属离子吸引电子或阴离子的能力被称为该金属 离子的“相对碱度” 。引力越强,碱度越弱。 碱度的强弱可用金属离子的离子势φ(=Z/r)来量度,离 子势值越大(即半径小,电荷高)则碱度越弱。 对于镧系电荷相同的离子, 随着原子序数增加,离子半 径减小,离子势逐渐增大,离子的碱度减弱。 碱度呈现单向变化的规律。 利用Ln3+离子半径的微小差别, 亦即碱度的微小差别, 可以对镧系离子进行分离。 4 Ln3+离子的碱度