
u&s 配体NO2在配合物中为什么有时称为 “硝基”,有时称为“亚硝酸根”? 16 正页下页节首节尾
16 Question 1 配体NO2 -在配合物中为什么有时称为 “硝基” ,有时称为“亚硝酸根”?
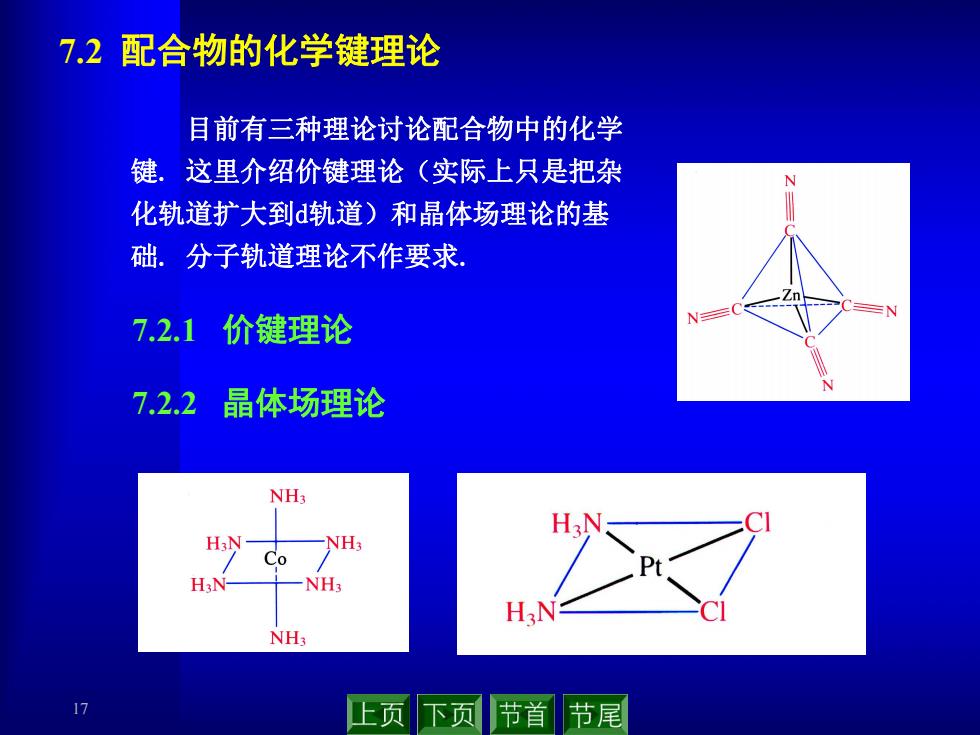
7.2配合物的化学键理论 目前有三种理论讨论配合物中的化学 键,这里介绍价键理论(实际上只是把杂 化轨道扩大到d轨道)和晶体场理论的基 础。分子轨道理论不作要求 7.2.1价键理论 7.2.2 晶体场理论 NH NH; Co H3N NH3 H3N NH: 17 上页下页 节首节尾
17 7.2 配合物的化学键理论 7.2.1 价键理论 7.2.2 晶体场理论 目前有三种理论讨论配合物中的化学 键. 这里介绍价键理论(实际上只是把杂 化轨道扩大到d轨道)和晶体场理论的基 础. 分子轨道理论不作要求
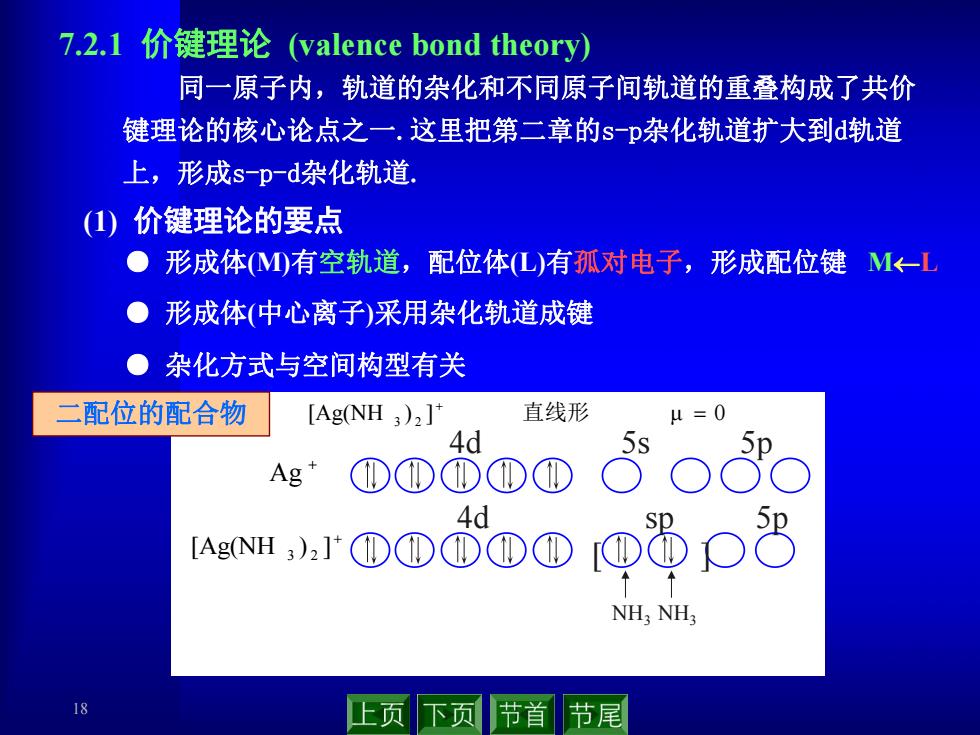
7.2.1价键理论(valence bond theory)) 同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价 键理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道 上,形成s-pd杂化轨道. (1)价键理论的要点 ●形成体M)有空轨道,配位体L)有孤对电子,形成配位键M<-L ●形成体(中心离子)采用杂化轨道成键 ●杂化方式与空间构型有关 二配位的配合物 [Ag(NH 3)2]" 直线形 4=0 4d Ag ①①①①① eNH,.rD①0①①@8O3 40 NH;NH; 公 上页下页 节首节尾
18 ● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键 ML ● 形成体(中心离子)采用杂化轨道成键 ● 杂化方式与空间构型有关 7.2.1 价键理论 (valence bond theory) 同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价 键理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道 上,形成s-p-d杂化轨道. (1) 价键理论的要点 [Ag(NH ) ] μ 0 3 2 直线形 [Ag(NH ) ] 3 2 [ ] NH3 NH3 4d sp 5p Ag 4d 5s 5p 二配位的配合物
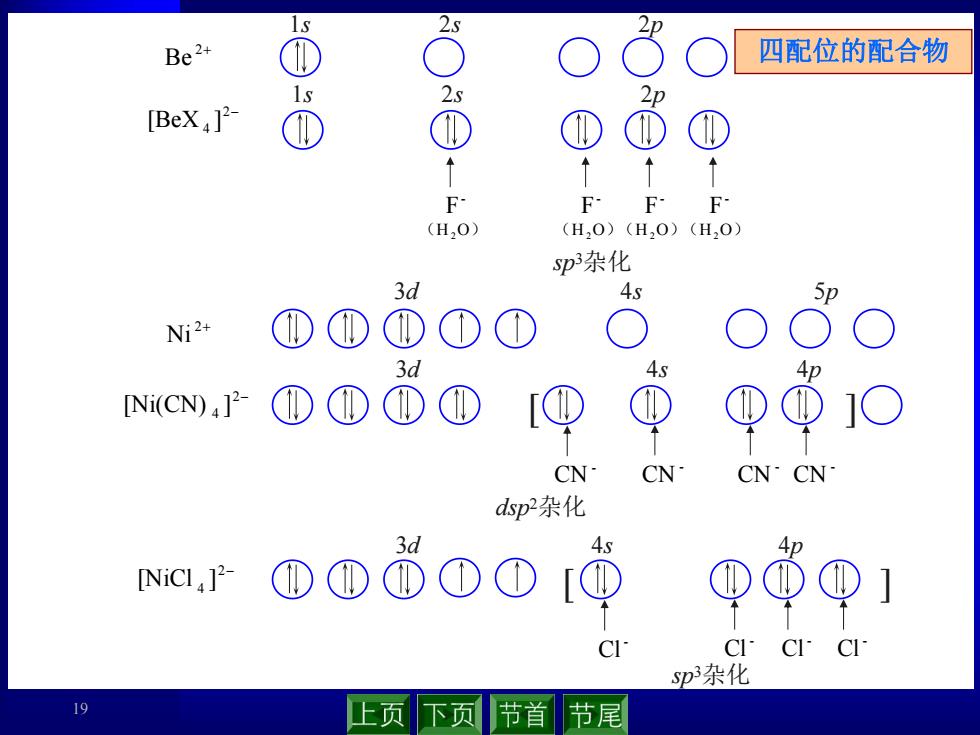
S Be2+ 四配位的配合物 2s 2p [BeX,]2 F FF·F (H,O) (H,0)(H20)(H20) p杂化 3d 4s Ni2+ ① ① ① 3d 4s Ap [Ni(CN)4]2 ① ① ① ① CN CN CN·CN dp杂化 ①①0D[ +S CICI CI p杂化 19 上页下页 节首 节尾
19 1s 2s 2p 2 Be 2 Ni 3d 4s 5p [ ] - CN - CN - CN - CN dsp 2杂化 2 4 [Ni(CN) ] 2 4 [BeX ] 1s 2s 2p - F - F - F - F (H2O) (H2O)(H2O)(H2O) sp 3杂化 [ ] - Cl - Cl - Cl - Cl sp 3杂化 2 4 [NiCl ] 3d 4s 4p 3d 4s 4p 四配位的配合物

六配位的配合物 [FeFc3-外轨配合物(outer orbital complexes)配位原子的电负 性很大,如卤素、氧等,不易给出孤电子对,使中心离子的结构不 发生变化,仅用外层的空轨道ns,np,nd进行杂化生成能量相同, 数目相等的杂化轨道与配体结合 [Fe(H2O)]2+(four unpaired electrons) 3d 4s 4p 4d ①①①①① ① ①①① ①① spd2 hybridization Octahedral hybrid orbitals 20 上顶 页 节首 节尾
20 [FeF6] 3- 外轨配合物 (outer orbital complexes) 配位原子的电负 性很大,如卤素、氧等, 不易给出孤电子对,使中心离子的结构不 发生变化,仅用外层的空轨道ns,np,nd进行杂化生成能量相同, 数目相等的杂化轨道与配体结合 六配位的配合物