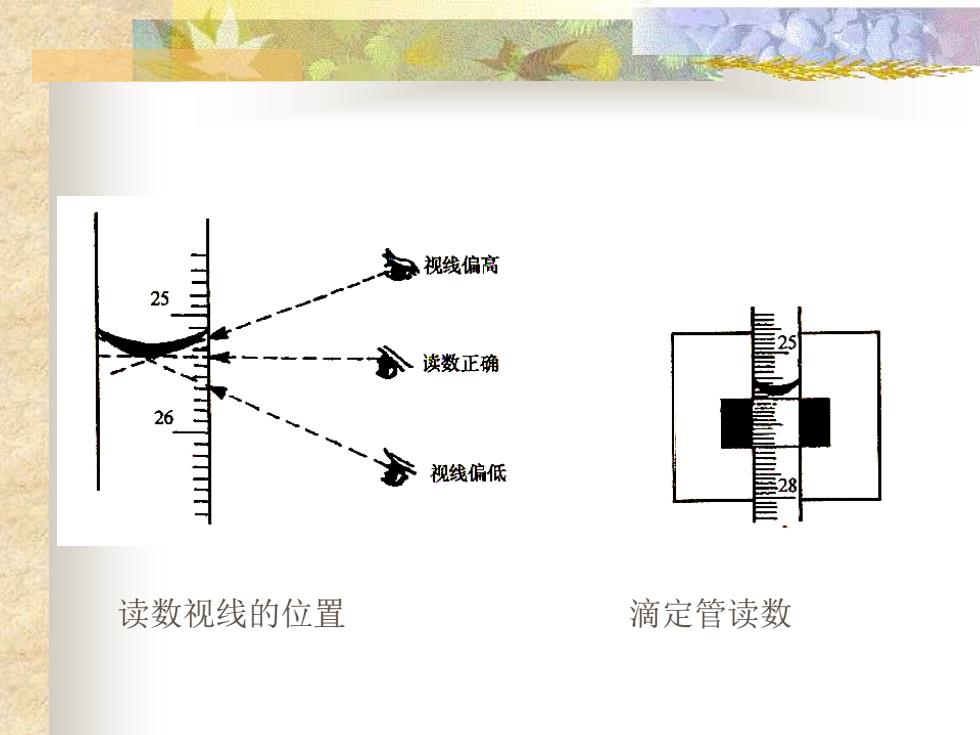
视线偏高 25 2 读数正确 26 视线偏低 读数视线的位置 滴定管读数
读数视线的位置 滴定管读数
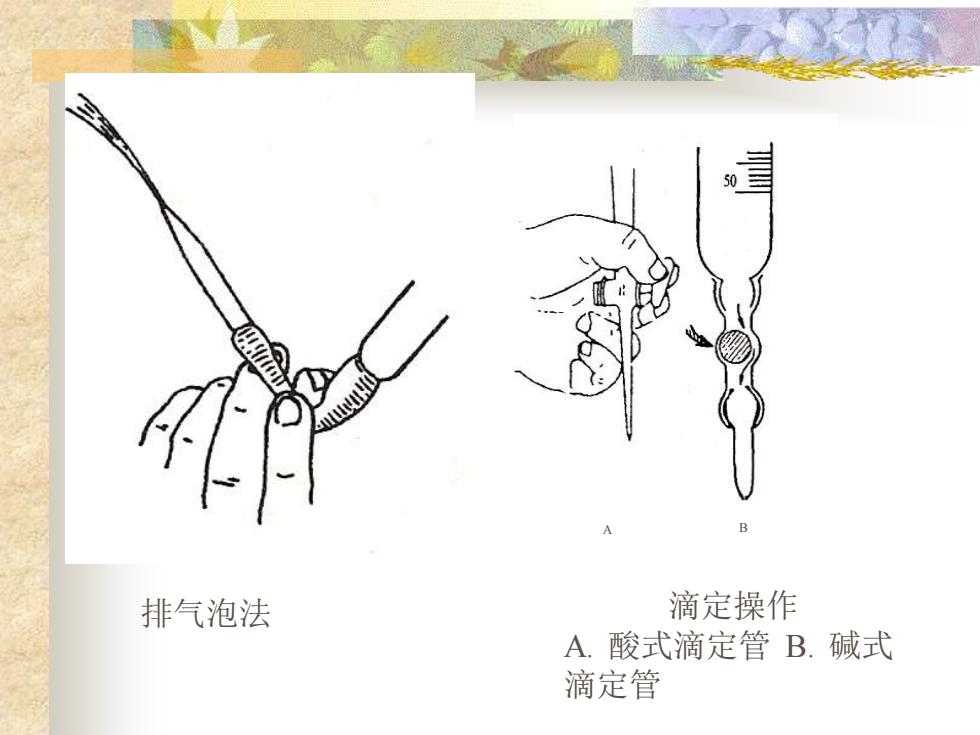
排气泡法 滴定操作 A.酸式滴定管B.碱式 滴定管
滴定操作 A . 酸式滴定管 B . 碱式 滴定管A B 排气泡法

酸碱标准溶液的比较 将约20mL碱液放人250mL的清洁锥形瓶内,加甲基红 指示剂1~2滴,瓶底衬以白纸,然后从酸式滴定管将酸液慢 慢滴入锥形瓶中,同时不断将锥形瓶摇动使溶液混合。继续 滴加直至溶液由黄色变成橙色为止。如有溶液溅起附于瓶壁 上,可用少量蒸馏水冲洗下。再将瓶移至装碱的滴定管下, 慢慢滴入碱液使呈现黄色。如此反复进行,至一小滴酸液的 加入,就能使溶液的颜色很明显的变为橙黄色(黄中略带红) 为止。记录读数,重复滴定二次。根据三次滴定结果,计算 出NaOH的浓度与HCI的浓度的比值,求平均值,计算平均相 对偏差
酸碱标准溶液的比较 将约20mL碱液放人250mL的清洁锥形瓶内,加甲基红 指示剂1~2滴,瓶底衬以白纸,然后从酸式滴定管将酸液慢 慢滴入锥形瓶中,同时不断将锥形瓶摇动使溶液混合。继续 滴加直至溶液由黄色变成橙色为止。如有溶液溅起附于瓶壁 上,可用少量蒸馏水冲洗下。再将瓶移至装碱的滴定管下, 慢慢滴入碱液使呈现黄色。如此反复进行,至一小滴酸液的 加入,就能使溶液的颜色很明显的变为橙黄色(黄中略带红) 为止。记录读数,重复滴定二次。根据三次滴定结果,计算 出NaOH的浓度与HCl的浓度的比值,求平均值,计算平均相 对偏差

弱酸电离常数及电离度的测定 Determining the Ionization Constant of a Weak Acid ■一实验目的: Objectives ■1.掌握溶液的配制和移液管、容量瓶的使用: ■ 2.熟悉电离平衡的基本概念, ■ 3.了解弱酸电离常数的测定方法和pH计的使 用
弱酸电离常数及电离度的测定 Determining the Ionization Constant of a Weak Acid ◼ 一.实验目的: Objectives ◼ 1.掌握溶液的配制和移液管、容量瓶的使用; ◼ 2.熟悉电离平衡的基本概念; ◼ 3. 了解弱酸电离常数的测定方法和pH计的使 用

二、实验原理 HAc HO H:O"Ac K?H'e l [HAc]/c {H,0]/e}2 C=Hac1cy-1H,o]c K日=[HO+]1c0}2 A[HAc]o /c0 a=H,0] [HAclo
❖ . 二、实验原理 HAc + H2 O H3 O + + Ac - (7 2) {[ ]/ } {[ ]/ } {[ ]/ } θ θ θ 3 − = + − HAc c H O c Ac c Ka (9 3) {[ ] / } {[ ]/ } {[ ]/ } θ 3 θ 0 θ 2 θ 3 − − = + + HAc c H O c H O c Ka {[ ] / } {[ ]/ } 0 2 3 HAc c H O c Ka + = 0 3 [ ] [ ] α HAc H O + =